牛津疫苗懶人包:第三期臨床試驗結果整理 英國通過緊急授權



英國阿斯特捷利康藥廠(AstraZeneca)和牛津大學合作的腺病毒疫苗「AZD1122」,第三期臨床試驗於6月15日開始收案,預計在巴西收案兩千人。
這是以一個黑猩猩的腺病毒(ChAdOx1)為載體的疫苗,在動物實驗上證明疫苗可以提供保護力。第一期/第二期合併臨床試驗發現此疫苗可產生抗體,且安全沒什麼副作用。目前在英國和印度進行第二期/第三期合併臨床試驗,也在巴西還有南非進行第三期臨床試驗。
五月時,美國提供12億美金的投資,訂下3億劑疫苗。八月時,歐盟和阿斯特捷利康簽訂4億劑疫苗的合約。 此外的訂單:日本1.2億劑,英國1億劑,巴西1億劑,COVAX 13億劑。若一切順利,預計可提供全世界每年20億劑的疫苗。這支疫苗是COVAX的待選疫苗之一,台灣有機會可以經由COVAX的途徑買到。
在價格方面牛津疫苗是訂價最便宜的疫苗,售價大約只有3英鎊,和一杯咖啡差不多,而輝瑞疫苗價格約15英鎊,莫德納疫苗約25英鎊。牛津疫苗的生產合作伙伴阿斯利康製藥公司表示,不會靠賣疫苗賺錢,生產出的疫苗提供任何國家使用,因此價錢最低。
且和輝瑞及莫德納這樣的RNA疫苗相比,牛津疫苗和其他大多數的疾病疫苗相同,不需要特別的冷鍊。牛津疫苗可以在一般冰箱的溫度下(攝氏2至8度之間)儲存至少半年,因此能夠輕鬆運送到世界各個角落。若考慮冷鍊運送和保存成本,RNA疫苗的成本就更貴了。
2020.11.19:牛津疫苗第二期臨床試驗發表在刺胳針期刊 年長者也有極好的抗體和T細胞反應
2020.11.23:牛津疫苗有七成保護力,不同劑量最高可達九成
2020.12.8:牛津疫苗第三期部分臨床試驗結果發表在刺胳針期刊 低劑量組讓人更疑惑
2020.12.30:英國通過牛津疫苗緊急使用授權 但我的問題更多了….
2021.1.11:英國MHRA公布牛津疫苗評估報告 下這樣結論的樣本數太少了….
2021.2.3 牛津疫苗公布多一個月的資料 只打一劑可有76%保護力,且效果至少維持90天
2021.2.8 AZ疫苗對抗南非變種病毒效力有限?南非政府緊急喊停醫護接種計劃
2021.3.2 英國大量施打研究顯示AZ/輝瑞疫苗皆在年長者有效 80歲以上長者可減少80%住院風險
2021.3.22 美國AZ第三期臨床試驗結果出爐 保護力79% 對重症和住院保護力100%
2021.3.23 AZ疫苗烏龍又一樁?
2021.3.25 AZ下修保護力到76% 結果只少了3%是哪招?
我在2021年1月4日直播講了這個題目,請參考!
時間軸:
40:43 英國給予牛津疫苗緊急使用授權 隔4~12週施打
41:10 英國MHRA率先批准牛津疫苗的緊急授權使用,但審查的資料和報告並沒有第一時間公開
42:05 批准全劑量打兩劑,兩劑可以間隔4~12週施打。兩劑間隔約12週施打保護效力可以升高到80%,只打一劑的話可達約70%的保護力。
46:18 04b解讀:這次MHRA和Lancet已經出版的臨床試驗結果數字顯然不一樣。美國FDA這次批准兩支RNA疫苗是完全儘量透明公開,美英兩國真的是完全不同風格…
47:55 我不會擔心牛津疫苗沒效,但最大的問題是,直到現在,實在搞不懂劑量應該怎麼給是最好的
51:40 讓輝瑞疫苗也建議可以到相隔12週施打,更是完全沒有科學基礎的建議
52:52 變種病毒B117在英國部份地區已經是主要流行株,而這繼續進行的臨床試驗中顯然沒有觀察到現有牛津疫苗失效,我想這點至少是比較令人安心的
56:20 英國拉長輝瑞2劑疫苗接種間隔期 官方醫界掀論戰 佛奇也不贊成
1:02:54 英國官方公布文件(應該還會有更詳細的)
http://bit.ly/35ac2z7


東京必備優惠券一整包 關西京阪神必備優惠券一整包

2021.3.25 美國AZ第三期臨床試驗結果正式出爐
保護力76% 對重症和住院保護力100%
結果只比79%減少了3%是哪招?
我必須說我真的是看不懂。之前曾傳出資料安全監測委員會(Data Safety Monitoring Borad;DSMB)質疑AZ使用的資料可能包含了過期的資訊,這可能對於此疫苗有效性解讀會不完整。但在48小時內,AZ公布了最新的數據,只比原本的79%低3%,降到76%。79和76是有差很多逆….
1.英國AZ藥廠和牛津大學25日再度分別發布新聞稿,表示之前22日公布的是到2月17日之前預定的內部分析。當時是141人新冠確診。而現在公布的資料是最後的分析,又多了49例確診,總共190人新冠確診。
2.這是多國多中心執行的臨床試驗,在美國,智利和祕魯共88家醫學中心執行。共收案32,449人,以2:1收案。
3.兩劑相隔4週施打,評估施打完第二劑15天後預防有症狀感染的效果。AZ疫苗保護力76%(信賴區間是68~82%)。
4.總共有8個重症發生,全部都發生在對照組。最重要的對重症和住院的保護力保持在100%。
5.在不同的年齡層和種族都能看到相當的保護力,在65歲以上有85%的保護力(信賴區間是58~95%)。
6.還有14例疑似案例還須要釐清,所以保護力之後還可能變化。
7.AZ準備和美國FDA申請緊急使用授權,也會很快的投稿到期刊。
04b解讀:
1.這週AZ疫苗真的是在坐雲霄飛車。DSMB做出這麼大動作,說用了沒有更新的資料可能會誤導對這疫苗保護力的解讀,結果保護力僅僅是小降3%,65歲以上保護力甚至還從80%升高到85%。
2.我看不懂的是如果DSMB已經知道了最後結果是這樣,為何要做這麼大的動作?我是真心不懂。疫苗看起來不錯,但這些單位的溝通實在是很爛。
3.Eric Topol就質疑,請問DSMB還有NIAID到底怎麼了?還有為何明明最後的分析已經快出來了,但AZ還要公開2月17日之前的內部分析?但他也預期,剩下的14例應該不會對結果影響太大,也預測美國FDA應該會很快通過AZ疫苗的緊急授權。這是很好的重建大眾對於這個疫苗信心的方式。
4.所以我等了兩天才報這個新聞,看會不會還有肥皂劇上演。似乎是沒有….好吧,如果是這樣的資料,真的還是非常不錯的保護力。之前在英國,南非和巴西做的AZ臨床試驗整體保護力僅有66.7%(信賴區間57·4–74·0,不管兩劑間隔),現在是76%。這其實也是意料之中,因為前者做臨床試驗的地方會面臨比較多變種病毒,在美國則不然。
AZD1222 US Phase III trial met primary efficacy endpoint in preventing COVID-19 at interim analysis
Latest results put Oxford–AstraZeneca COVID vaccine back on track
What to make of the AstraZeneca vaccine data — and the surrounding controversy
2021.3.23 AZ疫苗烏龍又一樁?
關於星期二和大家分享的AZ疫苗美國第三期臨床試驗保護力有79%的消息,後續可能會有修正。
資料安全監測委員會(Data Safety Monitoring Borad;DSMB)通知美國國家過敏和傳染病研究所NIAID(所長為Fauci),生物醫學先進研究與開發局BARDA還有AZ公司,表示他們很關切3月22日AZ公司所公布的第三期臨床試驗資料新聞稿可能包含了過期的資訊,這可能對於此疫苗有效性解讀會不完整。
NIAID隨後發表聲明,希望AZ公司盡快和DSMB一起合作,重新檢視保護力數據,並確保最準確、最新的保護力數據能夠盡快公布。
NIAID表示,該疫苗在美國的核准與使用指引,將由美國食品藥物管理局FDA及疾病管理暨防制中心CDC,在經過獨立專家委員會完整檢視數據之後,做出決定。
Fauci也上電視對此作出說明。表示他也被這件事嚇一跳。但既然已經收到通知,就不能不出聲。看來是AZ用了不是最新的資料,讓有效性看起來比較好,會讓人誤解。但佛奇也形容,他個人認為這應應該是unforced error 非受迫性失誤。(就是AZ公司不是故意的意思)
AZ則表示會在48小時內更新資料。
04b解讀:
1.資料安全監測委員會DSMB是在臨床試驗中由獨立沒有利益衝突的專家所組成,負責監測臨床試驗進行中所有的數據,安全性等等監測。現在的狀況應該是新聞稿一公布,DSMB發現新聞稿沒有呈現累積到現在最新的數據,可能會讓人對於有效性的解讀有誤導。
2.雖沒有具體說是什麼部分沒有更新,我猜測應該是針對整體有效性79%,對重症和住院保護力100%,還有在65歲以上有80%的保護力這三句話。至於會有怎樣的改變,就靜待48小時內AZ公司的說明了。
3.我有點無言為何會有這種狀況產生。會發生這樣的事情真的滿烏龍的。不過之前都已經不小心生出了一個半劑量組,好像也沒什麼事情是不可能的…..🤔
NIAID Statement on AstraZeneca Vaccine
‘I was sort of stunned’: Fauci and U.S. officials say AstraZeneca released ‘outdated information’ from Covid-19 vaccine trial
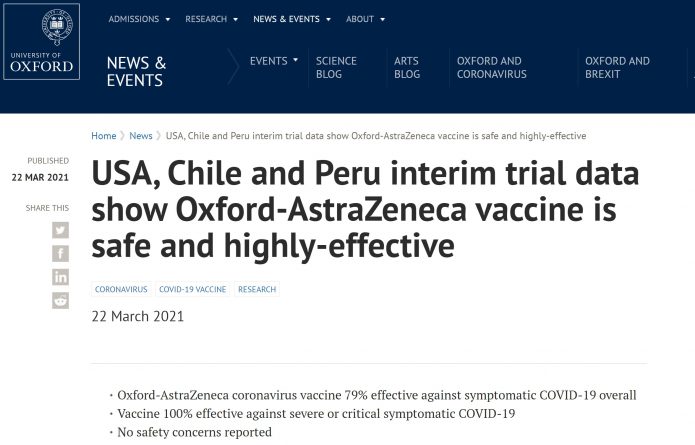
2021.3.22 美國AZ第三期臨床試驗結果出爐 保護力79% 對重症和住院保護力100%
這應該是好消息!順利的話AZ疫苗應該會成為美國緊急授權的第四支疫苗。
1.英國AZ藥廠和牛津大學22日發布,目前僅有新聞稿,還不是完整的結果。
2.這是多國多中心執行的臨床試驗,在美國,智利和祕魯共88家醫學中心執行。共收案32,449人,以2:1收案。
3.兩劑相隔4週施打,AZ疫苗保護力79%,對重症和住院保護力100%
4.在不同的年齡層和種族都能看到相當的保護力,在65歲以上有80%的保護力。
5.針對21583位疫苗組,血栓比例沒有增加。也沒有看到腦部靜脈血栓案例。
6.收案人種:79% white/Caucasian, 8% black/African American, 4% native American and 4% Asian, and 22% Hispanic.
7.有20%受試者是65歲以上,60%受試者是有慢性病,比方說糖尿病,嚴重肥胖或是心臟病這些新冠重症的高危險因子。
04b解讀:
1.這臨床試驗設計是相隔4週施打。沒辦法回答相隔8週,12週會不會比較好的問題。
2.台灣目前是參照英國,歐盟和WHO通過AZ疫苗的資料,訂出相隔8~12週施打AZ疫苗。接下來如何解讀此臨床試驗是大問題。美國FDA應該開始準備審查AZ疫苗,他們會決定該相隔多久施打,我很好奇。之前我也有和大家提過,我對於相隔12週反而效果較好這樣解讀的擔心。這裡就不重複了。
3.但不論如何,收案年長者較多,且有六成有慢性病,還可以有79%的保護力,應該算是好消息。
4.之前第三期臨床試驗65歲以上收案不夠多,但經過了3月1日英國公布了實際在年長者施打的效果,還有美國這個臨床試驗之後,AZ疫苗在年長者的效果應該是更為確認了。
5.順利的話AZ疫苗應該會成為美國緊急授權的第四支疫苗,Novavax則可能是第五支。預估應該分別在4月和5月會被FDA通過。我很期待FDA審查AZ疫苗,因為照往例應該會公布非常詳細的資料,包括血栓安全性問題,在英國,南非,巴西還有現在公布的美國各地所做加起來超過5萬人的臨床試驗,到底該怎麼整合起來一起解讀?我非常關注。
牛津大學新聞稿:USA, Chile and Peru interim trial data show Oxford-AstraZeneca vaccine is safe and highly-effective
AZ新聞稿:AZD1222 US Phase III trial met primary efficacy endpoint in preventing COVID-19 at interim analysis

2021.3.2
#牛津AZ疫苗終於雪恥?
#英國大量施打研究顯示AZ/輝瑞疫苗皆在年長者有效
#80歲以上長者可減少80%住院風險
1.如同以色列展示了輝瑞/BNT疫苗實際施打後的效果,英國政府衛生單位3月1日公布針對750萬名70歲以上長者進行的研究(也可以看到研究的預印本)。
2.針對英國全國70歲以上的長者約750萬人,在2020年12月8日到2021年2月19日這段時間有回報有症狀且做了PCR檢查者皆列入分析。
3.結果總共有174731人PCR結果,156930人有連結到疫苗施打資訊。其中44590人PCR陽性,112340人陰性。
陽性者有19960人注射AZ疫苗,12872人注射輝瑞/BNT疫苗,11758人沒接種。
陰性者有56425人注射AZ疫苗,49612人注射輝瑞/BNT疫苗,6303人沒接種。
由以上資料來分析保護力。
4.主要分別看施打後三大指標的效果:有症狀感染,住院和死亡。
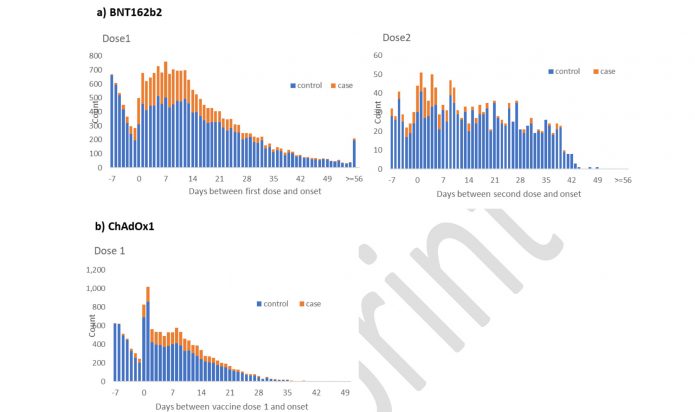
5.針對70歲以上:有打疫苗和沒打疫苗的確診者兩者分析得病的風險是差不多的。
接種第一劑輝瑞/BNT疫苗28~34天後,保護力61%(95%CI 51-69%)
接種第二劑輝瑞/BNT疫苗14天後,保護力85%(95%CI 79-89%) (但這組人非常少)
接種第一劑AZ疫苗14~20天後就可看出一些保護力
接種第一劑AZ疫苗28-34天後,保護力 60% (95%CI 41-73%)
接種第一劑AZ疫苗35天後,保護力 73% (95%CI 27-90%)
顯示無論打哪一種疫苗,4週過後保護力都相當,且AZ疫苗保護力還比輝瑞/BNT略高一些。但打第二劑的輝瑞保護率會衝高。
6.另針對80歲以上確診個案進行分析,發現接種疫苗3~4週後,對於確診者,兩種疫苗皆可有效防止住院達80%。
7.輝瑞/BNT疫苗可以減少85%的死亡。AZ疫苗這邊則因為較慢開始施打,資料較少沒有分析。
8.指揮中心發言人莊人祥今日記者會中也提到這個研究。並表示加拿大則是政府認為英國已經打了這麼多,長輩也沒出問題,因此開放AZ疫苗65歲以上長者接種,但加拿大的接種諮詢委員會並不建議施打。除此之外,上個月僅開放65歲以下民眾施打的法國,近日已開放65至74歲長者施打;而德國、韓國僅供65 歲以下民眾施打,但目前德國正研議放寬接種年齡上限。
莊人祥也指出,根據目前規劃,65歲以上族群將在疫苗具備一定數量時才會開放接種,未來將根據全球相關研究結果,滾動式檢討65歲以上族群的接種規劃。
04b解讀:
1.之前許多國家不建議在65歲以上施打AZ疫苗並不是因為效果不佳,而是因為在臨床試驗中收案較少,無法有確切結論。現在實際施打的研究做出來,若再加上美國執行的三萬人研究,我相信年長者應該也很快可以批准使用AZ疫苗。
2.這個研究重點是70歲以上長者無論接種AZ或BNT疫苗,單劑4週後保護力差不多,還能降低染疫長輩住院率。但別忘記了根據以色列的大型資料,輝瑞/BNT需要打第二劑,其保護力才會更進一步提高到高於九成。
第一劑後的14~20天對於有症狀感染保護力57%[95%CI, 50 to 63),住院保護力74%[95%CI, 56 to 86),重症保護力62%[95%CI, 39 to 80),對死亡的保護力72%[95%CI, 19 to 100)。
第二劑7天後對於有症狀感染保護力會升高到94%[95%CI, 87 to 98),住院保護力87%[95%CI, 55 to 100),重症保護力92%[95%CI, 75 to 100)。
英國之前公布AZ疫苗相隔12週效果較好,甚至對輝瑞/BNT疫苗也做此建議。我想之後他們會繼續追蹤直到12週之前輝瑞疫苗是否保護力可以持續,這是目前以色列的資訊還有大型臨床試驗中都沒有資料的部分。
3.目前這些人的追蹤時間還不夠,但至少能確定在六週的時間中保護力都能維持。本週開始英國會開始打第二劑,應該會有更高且可維持更久的保護力。
4.這個研究也是病例對照研究(Case‐control study),但以色列那篇的做法似乎是比較嚴謹的對照研究做法。不過能夠有這樣的結果出來,我想都是好事。
New data show both Pfizer-BioNTech and Oxford-AstraZeneca vaccines significantly reduce severe COVID-19 in older adults.
文章預印本
別怕銀髮族打AZ疫苗沒效 英研究證實保護力逾7成
Covid vaccines cut risk of serious illness by 80% in over-80s
2021.2.8
AZ疫苗對抗南非變種病毒效力有限?
南非政府緊急喊停醫護接種計劃

2021.2.3 牛津疫苗公布多一個月的資料 只打一劑可有76%保護力,且效果至少維持90天
牛津疫苗又多了新資料,預計發表在Lancet,預印已經看的到了。牛津大學也發表新聞稿。之前的資料是到11月初。現在多追蹤一個月。包括在英國,南非,巴西執行的四個臨床試驗綜合的結果。日本,印度,美國的資料還沒包括。
1.上次有效性資料是取自2020年11月4日之前,從英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003)共11636人來分析,有131位有症狀的新冠確診。
這次多追蹤了一個月,增加了南非COV005,總共17177人的資料(8948人在英國,6753人在巴西,1476人在南非),增加到332位有症狀的新冠確診。有效性是看施打第二劑14天後是否發生 有症狀的新冠確診。
2.這次特別針對只打一劑的效果分析,也進一步針對打第二劑間隔時間來分析。
3.總保護力
上次資料 62·1% (95%CI 41·0–75·7)
這次資料 66.7% (95%CI 57.4-74.0)
4.在打第二劑的15天之後,沒有確診的新冠案例需要住院。在對照組中則有15位需要住院。
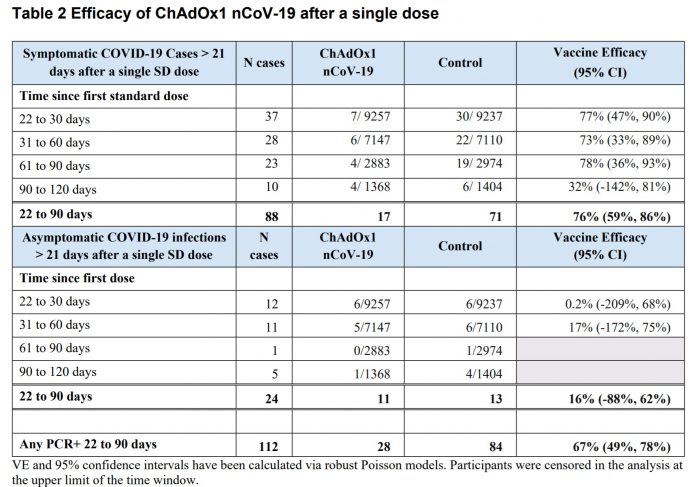
5.只打一劑,追蹤到22~90天,顯示其保護力是76%(CI 59–86)。而抗體的效價在90天期間幾乎不會消退。
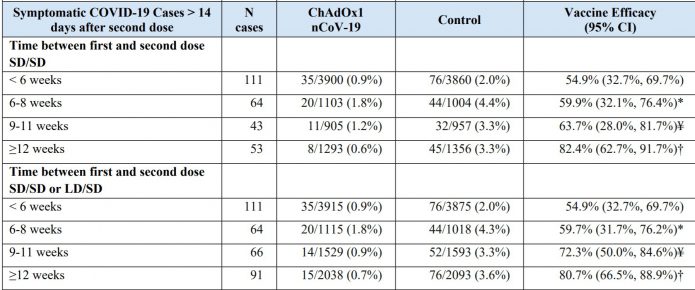
6.兩劑相隔時間越久,保護力越佳。
相隔小於6週:54.9% (95% CI 32.7–69.7)
相隔大於12週:82.4%(95% CI 62.7–91.7)
這在中和抗體的研究看來也是這樣,相隔12週以上施打的抗體效價比小於6週者高了2.19倍(這是18~55歲的受試者的資料)
7.研究的結論是,目前資料支持英國第二劑可以相隔3個月施打的政策。
8.在英國執行的研究中還有針對部分受試者每週獲得鼻和咽拭子來看感染與否。結果顯示注射單劑疫苗後,PCR檢測陽性率下降了49–78% 不等,顯示疫苗似乎有助減少病毒傳播。注射兩劑之後,PCR檢測陽性率下降了49.5%。
04b解讀:
1.英國學者繼續努力證明他們對於相隔4~12週施打的建議是正確的。但到目前為止,和上次的資料相比,主要是施打<6週和6~8週的人數變多些。
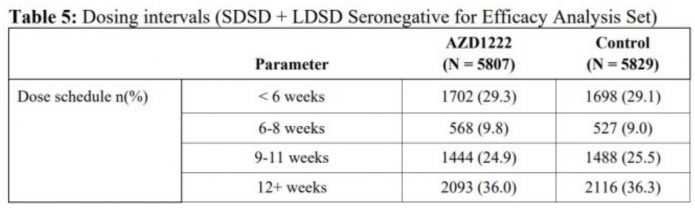
間隔<6週施打疫苗的人數從1702人增加到3900人。
間隔6~8週施打疫苗的人數從568人增加到1103人。
間隔9~11週施打疫苗的人數從1444人增加到1529人。
間隔>12週施打疫苗的人數從2093人變成2038人。
2.這次2月2日牛津大學公布的最新資料,說第一劑打完保護力達76%可維持至少90天。隔12週再打第二劑,保護力可達82.4%,不過若隔6周就打第二劑,保護力反而會降到54.9%。因此目前資料支持英國政府第二劑可以相隔3個月施打的政策。不過到目前為止,下這樣的結論可能還是會讓科學家有疑慮,因為大於12週施打的人數還是僅有兩千多人,且是免疫力較好的年輕人族群(許多都是5月最早施打的半劑量組)。
3.很引人注目的是這研究是否可證明疫苗可以阻斷病毒的傳播。目前為止的臨床試驗是關注有症狀的感染,但沒有在看施打者是否仍舊可以成為無症狀感染者,並且有機會傳染給他人。
目前這個資料顯示的是在注射疫苗後比較少人無症狀感染,研究者直接視此為減少在社區流行病毒的數量,因此可解讀為減少傳染他人的機會。但有專家質疑,這資料只是看到身上帶有病毒的人減少,病毒排放減少,並沒有直接證明傳染他人的機會減少。另外,只打一劑減少了67% ,但打兩劑卻只減少49.5%,這很難解釋。目前文章中也沒有對此提出解釋。
佛羅里達大學生統專家Natalie Dean表示,追加劑量通常效果應該會變好,而不是讓效果反而變差。這點真的讓人難以理解。這是否代表打一劑和打兩劑的這兩群資料是不應該這樣比較的?
4.我個人認為,本來對這個臨床試驗的解讀就要很小心。因為他不是原本就設計來回答打一劑和打兩劑的效力,也不是設計來回答施打間隔應該是小於6週或是大於12週。你在比較小於6週或是大於12週,還有一劑和兩劑的效果,但這兩組都不是隨機分配的,有太多因素可能造成影響。
5.AZ疫苗初期臨床試驗只希望打一劑,但後來看抗體資料才決定改為施打兩劑,陸續召回已經施打完第一劑的受測者,使得兩劑施打間隔從4~12週分散得非常廣。一般而言,受測者應在同條件下與對照組相比,以獲得科學統計上可信服之結果,比方說輝瑞就是相隔21天、莫德納就是相隔28天施打第二劑。牛津追加劑量原則是隔28天給予,但因為是後來追加,所以追加第二劑的時間差非常多。其中劑量不同,施打第二劑間隔不同,等於讓臨床試驗又多了好多組別,這讓整個臨床試驗難以解讀。
6.繼英國之後,歐盟1月底通過AZ疫苗緊急授權,但德國、法國認為對65歲以上族群保護力恐不足,瑞士更是直接拒絕給予緊急授權,認為臨床試驗資料不夠齊全。
結語:我不會擔心AZ疫苗沒有效,我對他還是有信心的,至少確定應可以有效防止重症。我只是不知道,到底應該怎麼施打比較好….證據還不夠完整。可能還是要等全部臨床試驗的資料出來,還有AZ於美國進行的4萬人臨床試驗結果於2月底出來,科學上的證據才會更完整。FDA緊急授權可能要等到3月了。
CNN報導:AstraZeneca vaccine appears to substantially reduce transmission of the coronavirus, study shows
紐約時報報導:The AstraZeneca vaccine may slow transmission of the virus.
STATNEWS報導:With a seductive number, AstraZeneca study fueled hopes that eclipsed its data
NHK也報導了
アストラゼネカ社ワクチン “1回目でも3か月後の有効性76%”
2021.1.11:英國MHRA公布牛津疫苗評估報告 下這樣結論的樣本數太少了….
英國MHRA在12月30日宣布批准了牛津疫苗的緊急授權使用後,在1月5日公布了他們詳細的評估報告。讓我們來看看吧。
1.此份的資料出自正在進行中的四個臨床試驗。四個臨床試驗都已經完成收案,在追蹤的階段(除了COV002還有兒童的族群還沒收案完成)。所有臨床試驗原本都預計只給一劑,後來在2020年6月根據免疫生成的結果,更改計劃書成為施打兩劑。追加劑量原則是隔28天給予,但因為是後來追加,所以追加第二劑的時間差非常多。
2.有效性資料是取自2020年11月4日之前,從英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003)共11636人來分析(和在Lancet公布的一模一樣)。安全性則是從英國,巴西和南非執行的四個臨床試驗超過兩萬人的資料來分析。COV001和COV005這兩個臨床試驗因為各自僅有少於5例新冠確診,因此這次沒有納入分析(各自僅有1例和2例,都在對照組)。
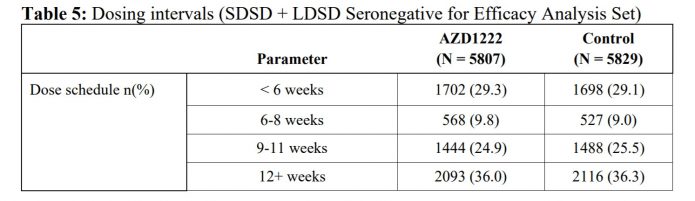
3.施打時間,可以看到兩劑小於六週施打僅佔29.3%,6~8週佔9.8%,9~11週佔24.9%,大於12週則佔了36%。分布的非常散。
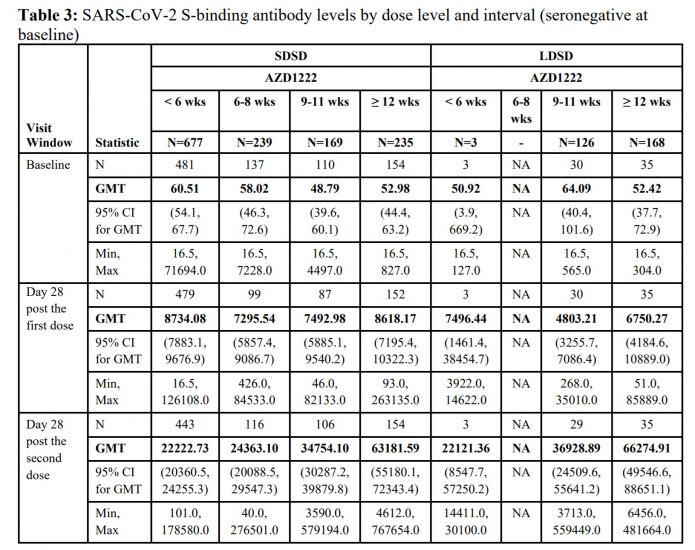
4.來看看抗體生成的效果。右邊是半劑量組(LDSD),左邊是全劑量組(SDSD)。我們可以看到第2劑間隔12週打,反而抗體升的高。但要注意,半劑量組幾乎都是在相隔9週之後施打,僅有3個人是相隔小於6週施打的。而比較半劑量組打第二劑後28天的抗體,兩劑相隔大於12週的抗體效價比相隔9~11週高很多。這在左邊的全劑量組也有看到。
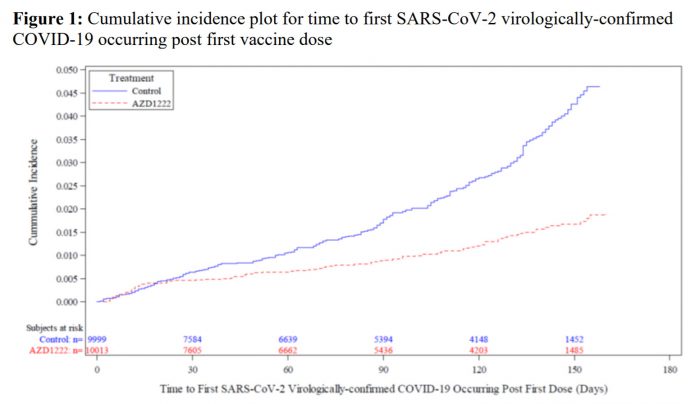
5.保護力大概在注射第一劑後第21天顯現效果,且至少可以維持12週。(之後未知,因為就打了第二劑了!)
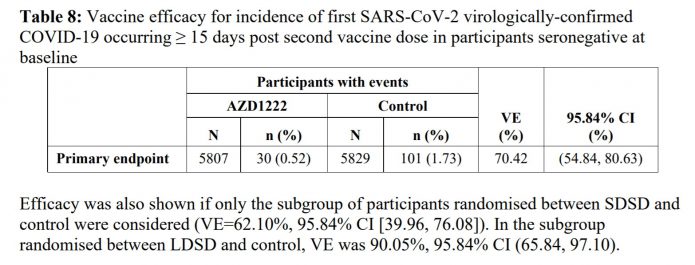
6.這已經公布過了,就是兩者合在一起的資料(共11636人),保護力是70.42%(95% CI 54·84–80·63)。
標準劑量組:4440人中有27人(0.6%)得新冠,相對於對照組4455人中有71人(1.6%)得新冠,保護力僅有62.1%(95.84% CI 39·96–76·08)。
低劑量組:1367人中有3人(0.2%)得新冠,相對於對照組1374人中有30人(2.2%)得新冠,保護力可達90.05%(95.84% CI 65·84–97·10)。
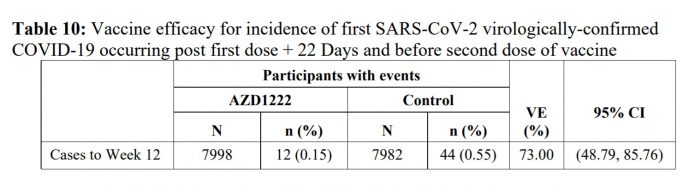
7.記者會中專家表示只打一劑的話可達約70%的保護力,是出自這個表。在打完第一劑22天後,追蹤到第12週打第二劑之前,估計保護力是73%。
8.記者會中專家表示在一群受試者兩劑間隔約12週施打,這樣的保護效力可以升高到80%,出自這一段。
Subgroup analyses were conducted of vaccine efficacy by dosing interval. In line with immunogenicity data where increases in the binding and neutralising antibody responses were observed with increased dosing interval, efficacy was demonstrated with more certainty for dose intervals from 8-12 weeks. For the subgroup with dosing interval 8-11 weeks, VE was 72.85%, 95% CI (43.45, 86.97), for the subgroup with dosing interval > 11 weeks, it was 81.90%, 95% CI (59.93, 91.90). Exploratory subgroup analyses showed vaccine efficacy around 80% for longer dosing intervals, but data were limited and estimates were associated with wide confidence intervals.
隔8~11週施打,保護力72.85%, 95% CI (43.45 to 86.97)
隔>11週施打,保護力81.9%, 95% CI (59.93 to 91.90)
他們也有去作相隔更長施打時間的亞組分析,可以到大概80%的有效性。但因為人數不多,所以95%信賴區間很廣。
04b解讀:
1.首先我必須說,這個研究要作出分析很困難。這綜合了四個收案條件各自不太相同的臨床試驗,其中劑量不同,施打第二劑間隔不同,等於讓臨床試驗又多了好多組別,這讓整個臨床試驗難以得出統計學上有顯著意義的結果。
2.為何需要作人數很多的大規模臨床試驗?就是因為在科學上希望能得到比較確切的結果。我們不可能對全體人類執行臨床試驗,因此選擇可以代表母群體的一群人,在這群人身上看到疫苗有沒有效,如果執行人數越多,科學家當然越有信心所觀察到的數據是真實而不是靠機率才出現的。所謂的95%信賴區間,就是我們有95%的信心你再重複作一次這樣的臨床試驗,數字會落在這個區間之內。
牛津疫苗施打間隔相隔8~11週還有大於12週的人,僅有3537人。僅從3537人這樣的人數就做出這麼重大的結論,說可以相隔12週再施打第二劑,且效果比較好,我個人會覺得有點擔心。
來作個對比吧!
莫德納疫苗施打15210人(另外是對照組),保護力94.1%(95% CI, 89.3 to 96.8%)
輝瑞/BNT疫苗施打21720人(另外是對照組),保護力 95% (95% CI, 90.3 to 97.6%)
莫德納和輝瑞各自是三萬人和四萬人的大型臨床試驗,且受試者注射劑量都一樣,因此可以獲得如此確切的結果。但英國牛津MHRA建議可以間隔長達12週施打的科學證據,其95%信賴區間落在59.93到91.90之間。這科學證據實在還不夠確切。
3.而半劑量組和全劑量組大概各半,別忘了半劑量組都是18~55歲,所以這其實也很難釐清是不是因為年齡造成的影響讓這群人的效果看起來較好。
4.STAT網站這篇文章也提到,有些專家擔心如果讓只施打一劑沒有完整免疫力的民眾面對病毒,是否會加速病毒學會如何對抗這個疫苗?特別是,英國首批施打的是最年長最脆弱的族群。
5.牛津疫苗在南非也有收案。是不是可以合理的猜測南非變種病毒應該對疫苗還是有效的,不然他們應該會發現疫苗組一堆人染疫才對?
6.總之,我認為牛津疫苗該如何使用可能還得看美國執行的部分。不過美國執行的是間隔四週施打。這該怎麼辦呢….要不要修改?理論上最好應該是分4週組和12週組來進行啦。

2020.12.30更新:英國通過牛津疫苗緊急使用授權 但我的問題更多了….
1.就在台灣指揮中心宣布我們購買一千萬劑的疫苗就是牛津/AZ疫苗的同一天,英國藥品及保健產品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)率先批准了牛津疫苗的緊急授權使用,但他們審查的資料和報告並沒有第一時間公開。
2.MHRA首席執行長芮恩(June Raine)在唐寧街進行疫苗簡報表示,批准的是全劑量打兩劑,兩劑可以間隔4~12週施打。記者會中專家表示在一群受試者兩劑間隔約12週施打,這樣的保護效力可以升高到80%,因此做出此建議。只打一劑的話可達約70%的保護力。
3.MHRA沒建議半劑量,因為他們認為之前半劑量組九成有效性的結論主要是因為拉長施打間隔所致。
4.英國的新冠單日確診數29日才首度突破單日4萬人,今天又突破5萬人,新增5萬3135人確診,疫情十分嚴峻。衛生大臣韓考克(Matt Hancock)表示,英國當局訂購1億支牛津大學疫苗,每人施打2劑,足夠讓5000萬人施打;加上先前的輝瑞/BNT疫苗,將足以供應全英國人口。牛津疫苗不像輝瑞疫苗必須保存在攝氏零下70度環境,只要冷藏即可,較容易儲藏與配送。
5.英國首相強生說牛津疫苗研發是英國科學界的勝利,並表示「我們將盡快讓所有人獲得接種。」由於英國已經有兩款疫苗獲得許可,雙管齊下希望能在1週內讓200萬人接種。自從90歲老婦人基南(Margaret Keenan)在12月8日率先接種疫苗之後,至今英國已有60萬人接種。
6.MHRA也同時更改了對輝瑞疫苗的施打建議,從原本在21天時施打第二劑,改為至少離21天,且可以和牛津疫苗一樣延後至4~12週再打第二劑。
04b解讀:
1.這次MHRA和Lancet已經出版的臨床試驗結果數字顯然不一樣。他們拿到的資料應該是最新的,英國一直在滾動式審查其資料,所以可以很快的批准。但他們沒公布詳細的評估報告,只說之後會公布。
2.對於全世界投予期待迫切希望能解決問題的新冠疫苗來說,大眾對他的信任應該是重中之重。美國FDA這次批准兩支RNA疫苗是完全儘量透明公開,資料先上網,直播八小時的開會過程,最後還是記名投票的。因為美國知道這兩個疫苗全部科學家都會以放大鏡來檢視,因此採取了盡量透明的策略。
3.我不會擔心牛津疫苗沒效,但最大的問題是,直到現在,實在搞不懂劑量應該怎麼給是最好的…半劑量全劑量,4~12週,都已經緊急授權了還神神祕祕不公布資料?這陣子以來牛津疫苗上發生的每件事都會讓人質疑不夠透明,從橫斷性脊髓炎,新聞稿公布,到現在連英國MHRA自己都神神秘秘的。我只能說美英兩國真的是完全不同風格…
4.兩劑可以間隔4~12週施打,會有這樣的時間差是因為牛津臨床試驗原本想只打1劑,後來才決定要打第2劑,這讓受試者的施打時間就是分布在4~12週之間。但另外一個考慮是如果這樣建議,短期間疫苗還短缺的時候就可以讓更多人施打第1劑獲得相當的保護效果,不論個人的保護力,這學理上可能對整體疫情控制是有好處的。
但在記者會上所回答的 #施打間隔相隔12週可以達到80%保護力,#只打1劑有70%的保護力,如果真的是這樣很好,但請給我看完整的臨床試驗數據。之前已經公布的Lancet的論文中標準劑量僅有62.1%的保護力,也曾以施打間隔小於6週或大於6週為切點來分析,並無看出顯著差異。我會懷疑至今能累積多少案例支持這樣的結論。
5.至於要讓輝瑞疫苗也建議可以到相隔12週施打,更是完全沒有科學基礎的建議。輝瑞臨床試驗就是相隔21天施打,這可能讓這個施打疫苗的個人無法獲得完整的保護力。且聲稱輝瑞1劑疫苗追蹤到21天就有多少保護力是較無意義的,因為21天後就打了2劑疫苗,打1劑疫苗後只觀察21天有一定的保護力,但沒有人知道如果真的只打1劑的話保護力是多少。因為臨床試驗中根本沒這個組別呀。
6.變種病毒B117在英國部份地區已經是主要流行株,而這繼續進行的臨床試驗中顯然沒有觀察到現有牛津疫苗失效,我想這點至少是比較令人安心的。
7.美國和歐盟的法規單位都表示,牛津疫苗大概需要到2021年2月左右才可能會被緊急授權。美國會希望等待更多在美國執行的AZ臨床試驗結果出來。歐盟的話,到12月底還沒有收到此疫苗的緊急授權申請。
英文好的朋友建議直接看記者會,後面記者問的問題很讚。英國記者非常會問問題!
新聞稿在此
Second COVID-19 vaccine authorised by medicines regulator: Oxford University/AstraZeneca vaccine meets regulator’s strict standards of safety, efficacy and quality.
紐約時報:U.K. Authorizes Covid-19 Vaccine From Oxford and AstraZeneca
路透社:No half measures and mind the gap: UK nod for AstraZeneca vaccine raises more questions
2021.1.2更新:英國拉長輝瑞2劑疫苗接種間隔期 官方醫界掀論戰 佛奇也不贊成
1.英國在通過牛津疫苗第二劑可在4~12週後施打,並說先一步通過的輝瑞/BNT疫苗第2劑也可從原本的3週延後到12週施打,引來醫界和專家異議。英國官員強調,這能讓盡可能多的人接種第一劑疫苗,此決定將盡可能多保護感染風險較高的民眾。
2.輝瑞藥廠於12月31日聲明:「輝瑞和BioNTech 的新冠疫苗第3期臨床試驗,是設計來評估間隔21天接種2劑疫苗後的安全性和有效性。沒有資料證明,接種第一劑疫苗後,過了21天,防護力仍然持續。」
3.代表醫師的英國醫學會(BMA)批評,這將讓目前正等候接種第2劑疫苗的極脆弱患者延後預約接種時間。
4.英國醫學會全科醫師委員會(General Practitioners Committee)主席沃特里(Richard Vautrey)指出:「極高齡患者群體若染上COVID-19,死亡風險最高,這就是為什麼全科醫師如此擔心他們。現在要數以萬計風險最高的患者試著重新安排接種時間,顯然相當不公平。」
5.英國醫師協會(Doctors’ Association UK)今天也對新的疫苗策略提出「嚴正關切」,警告此舉會破壞國民健保署(NHS)的患者同意程序,「也完全沒有遵循科學」。
6.英格蘭、蘇格蘭、威爾斯和北愛爾蘭首席醫療官員昨天在寫給醫護專業人員的公開信中,聯合替新的疫苗策略辯護。他們說,這項決定是基於「風險和效益的平衡」。「短期來說,第2劑疫苗帶來的額外增加效力可能不是很大;對臨床疾病的初期保護力絕大多數是在第一劑疫苗接種後開始。」
7.佛奇在CNN專訪中表示:從臨床試驗中我們知道莫德納第二劑是間隔28天施打,輝瑞是間隔21天施打。你可以爭論說拉長施打時間會不會有效,但我不建議如此做。
04b解讀:
1.第2劑疫苗帶來的額外增加效力可能不是很大—>這句話是猜測,是沒有科學證據的。輝瑞疫苗從第1/第2期開始就是打兩劑,並沒有只打1劑的組別可以觀察。只以科學觀點來看,英國這舉動非常瘋狂。輝瑞臨床試驗就是相隔21天施打,延長施打時間有可能讓這個施打疫苗的個人無法獲得完整的保護力。
2.當然我明白這是基於公衛的決定,英國目前疫情嚴峻且疫苗供應有限,希望能延遲第2劑讓更多人更快施打到疫苗而有一定的保護力。在12週之後,希望疫苗產能已經可以追上來,再讓大家補接種。這個決定有點大膽。
3.另外要提醒的是牛津是腺病毒疫苗,和輝瑞莫德納這種RNA疫苗是否打第2劑,還有打第2劑間隔要多少,可能答案是不一樣的。因為腺病毒疫苗一般來說有可能第2劑反而效果不好,抗體無法進一步提升,搞不好拉長注射間隔會較好。但其它疫苗通常第2劑會有加強效果(booster effect),可以延長保護的時間。
Dr Anthony Fauci says US will not delay second doses of Covid vaccine
中央社報導:英國拉長輝瑞2劑疫苗接種間隔期 官方醫界掀論戰

2020.12.8:牛津疫苗第三期部分臨床試驗結果發表在刺胳針期刊 低劑量組讓人更疑惑
最晚公開新聞稿的牛津疫苗,卻最早將第三期臨床試驗發表在刺胳針期刊(Lancet),離公布新聞稿僅有15天。這天也是英國開打新冠疫苗的日子,不過開打的是輝瑞/BNT疫苗,並不是英國自己的牛津/AZ疫苗。快來仔細看看!
目前公布的資料出自正在進行中的四個臨床試驗的內部分析,有效性是從英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003)共11636人來分析,安全性則是從英國,巴西和南非執行的四個臨床試驗超過兩萬人的資料來分析。整個第三期全球會收案到六萬人,目前只是部份的資料。
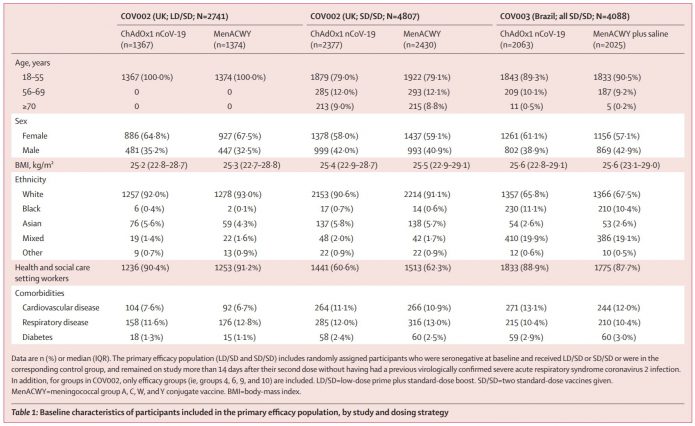
受試者是大於18歲的成人,1比1的收案為疫苗組或是對照組。疫苗組主要是打兩劑的標準劑量組(SD/SD cohort),英國COV002有4807人,巴西COV003有4088人。在英國則有多出一個低劑量組(LD/SD cohort),2741人。
低劑量組(第一劑的劑量僅有半量,之前解釋過這是不小心多出來的,劑量誤差是承包商所致,發現問題後督導單位立即通報並決定繼續試驗,改計劃書分為不同劑量組進行。但這2741人僅在18~55歲收案,且是密集在2020年5月31日到6月10日中收案的。後來發現問題,計畫書在6月5日改變,之後就是打全劑量了。56~69歲是8月8日開始收案,≥70歲是8月13日開始收案。
另外還有一個問題,18-55歲這組原本是設計僅要給一個劑量。但因為後來發現給兩劑的免疫生成會比較好,所以在7月20日更改計畫書要追加一劑,變成施打兩劑。8月3日開始追加劑量,因此在年輕人組兩劑間的間隔時間可能長達兩個月以上,會遠大於年長組的平均隔28天施打(年長組從開始就計劃要打兩劑)。
主要有效性指標是看注射完第二劑14天免疫力產生後,追蹤有症狀的新冠確診案例。資料追蹤至2020年11月4日。
結果:
1.從2020年4月23日到11月4日為止,共有23848位受試者參加,其中11636人包括在這次的有效性分析(英國7548人,巴西4088人)。
2.目前總共131例新冠確診,疫苗組中有30個,安慰劑組中有101個確診。在疫苗組中即使確診,也沒有新冠重症或須要住院的。注射完第一劑21天之後,共有10個因為新冠確診需要住院的案例,全部發生在對照組。其中有兩例是新冠重症,一例死亡。
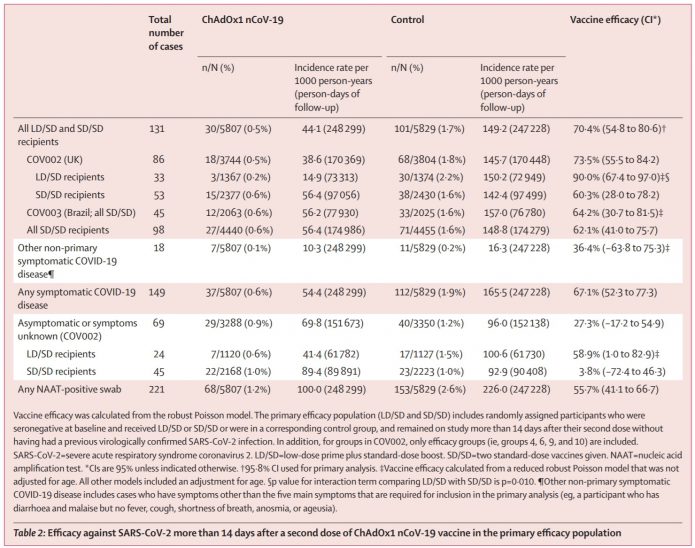
3.標準劑量組:4440人中有27人(0.6%)得新冠,相對於對照組4455人中有71人(1.6%)得新冠,保護力僅有62.1%(95% CI 41·0–75·7)。
低劑量組:1367人中有3人(0.2%)得新冠,相對於對照組1374人中有30人(2.2%)得新冠,保護力可達90%(95% CI 67·4–97·0)。
兩者合在一起的資料(共11636人),保護力是70.4%(95% CI 54·8–80·6)。
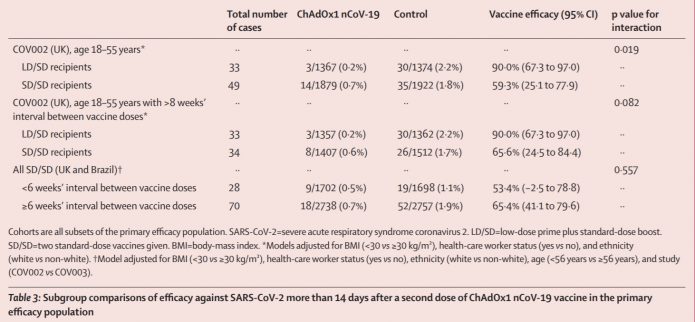
4.這是若只看英國18~55歲者,英國兩劑是不是大於8週,還有英國巴西兩劑小於6週或是大於6週來分。由於低劑量組只有收18~55歲,且絕大多數都是兩劑間隔大於8週,沒有年長者半劑量的資料。我們大概只能說,年長者劑量間隔拉長好像保護力有點變好,但我們無法確認18~55歲到底是因為半劑量讓效果變好,還是因為間隔拉長,還是兩者都有關。
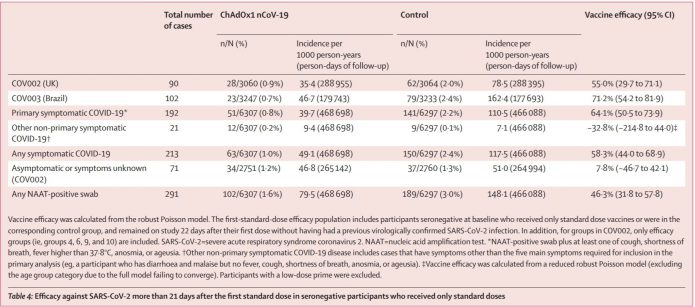
5.有趣的是,只看PCR陽性的話,也有抓出一些無症狀感染者。
6.安全性方面,目前累積74341 人-月的追蹤 (中位數3.4個月)。在168位受試者共發生了175件嚴重不良事件,其中84件在疫苗組,91件在對照組。有三件可能和疫苗相關,有一件是在新冠疫苗組,另外有一例還沒解盲。
牛津臨床試驗追蹤兩萬多人中共發生了五死。一個是對照組中產生的新冠重症。另外四死是車禍,外傷,他殺,還有黴菌的肺炎,一例在疫苗組三例在對照組。
一例是最早傳出的脊髓炎,發生在注射疫苗後14日。判定可能和疫苗有關。
另外還有兩例脊髓炎,一例是疫苗組一例是對照組。疫苗組這新聞中也有報導過,就是一開始認為和疫苗相關,但後來調查應該是病人本來就有未診斷的multiple sclerosis。因此目前判定和疫苗不太可能相關。

2020.11.23:牛津疫苗有七成保護力,不同劑量最高可達九成
沒想到牛津/AstraZeneca合作的疫苗第三期臨床試驗的初步結果也這麼快就出來了。平均保護力70%,但如果更改疫苗劑量的話保護力可以提高到90%。到底怎麼回事?來整理一下!
1.目前公布的資料出自在英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003),共收案兩萬三千人,其中約半數的參與者在英國,其餘在巴西。整個第三期全球會收案到六萬人,目前只是部份的資料。
2.此臨床試驗有兩種不同打法。都是打兩劑,但第一劑的劑量不同。
2741人:第一劑打半量的效果反而好,保護力可達90%。
8895人:第一劑打全量的,保護力僅有62%。
兩者合在一起的資料(共11636人),保護力是70%。
目前總共131例新冠確診,疫苗組中有30個,安慰劑組中有101個確診。在疫苗組中即使確診,也沒有新冠重症或須要住院的。新聞稿並沒有公布安慰劑組中有幾例重症或住院。
3.沒有確認和疫苗有關的嚴重不良反應。(我說呀,那個橫斷性脊隨炎到哪裡去了….)
4.BBC報導指出,輝瑞和莫德納研發的疫苗都有95%的保護力,而牛津研發的疫苗只有70%的保護力,可能有人對此會感到失望。但是,任何能取得50%以上保護力的疫苗都算是成功,70%也比一般的季節性流感疫苗要更好。
5.新聞稿上沒有,但新聞有報導他們還觀察到在疫苗組中無症狀感染者也減少了。這可能代表疫苗也可以減少經由無症狀感染者人傳人的機會。但目前沒有看到詳細的數字。
佛奇的意見:
1.為何打一半量的效果反而好?這應該很多人會有意見。但佛奇表示,這可能反而消除了對使用兩劑病毒載體疫苗的擔憂。如同李秉穎老師常說,使用腺病毒當載體把S蛋白帶進人體,若人體對此病毒載體有抗體,疫苗效果可能會變差。
佛奇猜測,一開始較低劑量已經足夠引發身體產生T細胞免疫,但沒有引發產生對腺病毒的抗體在打第二劑時反過來壓制第二劑應有的加成(booster)效果。
2.如果最後累積更多資訊,結論是保護力真的只有70%,那我們面臨一個難題。當你已經有兩個保護力95%的疫苗,那70%的這個怎麼辦?要在哪些人身上注射呢?
3.佛奇也提醒,在還沒有看到全部資料之前,不要輕易下結論。
04b解讀:
1.一定會寫上的警語:要提醒這僅是新聞稿,詳細資料還沒正式發表。追蹤時間還不夠長,時間更久也許疫苗組還是可能染病。且還有很多問題待解,到底可以徹底預防感染嗎?在不同族群,特別是年長者保護力如何?保護力可維持多久?但我想初步有這樣的結果是讓人樂觀的。
2.不過牛津的這個新聞稿,必須說實在不夠透明呀。公布的資訊少的可憐。我也覺得很奇怪,原本有風聲傳出12月底前第三期臨床試驗初步結果才會出來,但現在早了一個月,且僅有其中11636人的資料,不像另外兩個美國的臨床試驗都是收了三萬,四萬人的資料。有點想提早公布,但資料還準備不全的感覺。
3.為何打一半量的效果反而好?有人說,可能和對腺病毒載體的抗體有關,或是從低量到高量的暴露讓抗體產生效果較佳。這裡目前我沒有太好的答案。打半量的組別僅有近三千人,可能資訊還不夠多到可以下確切結論。不管如何,打一半量的效果好可能算是好事,可以讓更多人施打。
4.也有美國專家批評這次牛津疫苗臨床試驗整個透明度不夠高。比方說,莫德納和輝瑞都是第一時間就把臨床試驗計畫書公布讓全世界都可以看,很早就訂出何時要做內部分析,牛津就沒有。牛津/AZ這次處理真的不夠透明,從橫斷性脊髓炎不良反應事件的處理,到這次新聞稿的發布,都看的出來。你們知道嗎?美國的牛津疫苗四萬人臨床試驗8月18日開始收案,根本沒有半劑量的組。英國佬到底在搞什麼….哈哈。STAT網站報導,AZ預計要在美國的臨床試驗也增加半劑量的組別。不過這樣就意味,整個臨床試驗出來的時間又要往後延遲了。
老美就說了:
我很高興這不是第一個我們需要解讀的疫苗,因為這結果對於專家和一般人來說,都是同樣的令人困惑。
I’m glad this is not the first vaccine to read out, because it is awfully confusing for experts and non-experts alike.
5.牛津疫苗有在COVAX的第一批九支候選疫苗之中,台灣有機會可以經由COVAX的途徑買到。五月時,美國提供12億美金的投資,訂下3億劑疫苗。八月時,歐盟和阿斯特捷利康簽訂4億劑疫苗的合約。 此外的訂單:日本1.2億劑,英國1億劑,巴西1億劑,COVAX 13億劑。若一切順利,預計可提供全世界每年20億劑的疫苗。
6.在價格方面牛津疫苗是訂價最便宜的疫苗,售價大約只有3英鎊,和一杯咖啡差不多,而輝瑞疫苗價格約15英鎊,莫德納疫苗約25英鎊。牛津疫苗的生產合作伙伴阿斯利康製藥公司表示,不會靠賣疫苗賺錢,生產出的疫苗提供任何國家使用,因此價錢最低。
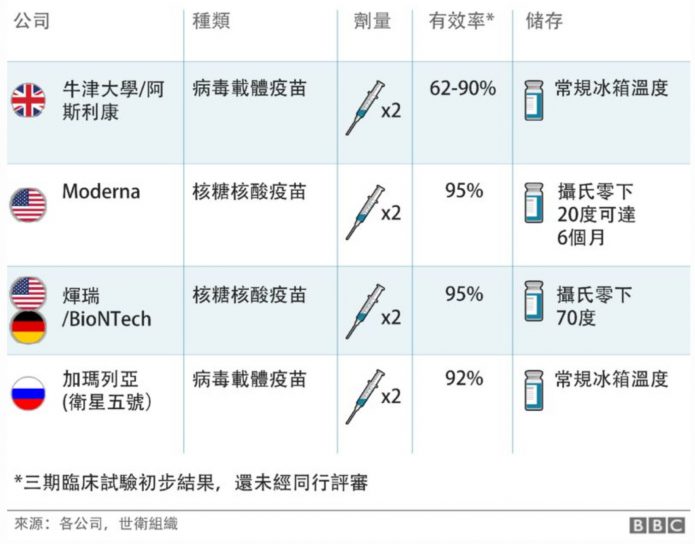
7.且和輝瑞及莫德納這樣的RNA疫苗相比,牛津疫苗和其他大多數的疾病疫苗相同,不需要特別的冷鍊。牛津疫苗可以在一般冰箱的溫度下(攝氏2至8度之間)儲存至少半年,因此能夠輕鬆運送到世界各個角落。若考慮冷鍊運送和保存成本,RNA疫苗的成本就更貴了。
8.不論如何,以全世界的觀點,牛津疫苗是比前面兩個RNA疫苗更有機會可以大量施打,解決問題的。希望接下來會有更多好消息。
新聞稿:AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19
BBC:Covid-19: Oxford University vaccine is highly effective
新冠疫苗:牛津疫苗研發成功 三種疫苗各有優勢
紐約時報:AstraZeneca’s Coronavirus Vaccine, Easy and Cheap to Produce, Appears Effective
STATNEWS:AstraZeneca Covid-19 vaccine is 70% effective on average, early data show

2020.11.19:牛津疫苗第二期臨床試驗發表在刺胳針期刊 年長者也有極好的抗體和T細胞反應
首先寫在最前面,許多媒體把牛津疫苗99%產生抗體的這個數字和輝瑞的95%還有莫德納的94.5%有效性(efficacy)相比,這是不倫不類的。99%這是immunogenecity(免疫生成性)的資料,是否可以真正預防感染,這要做完第三期才知道。這兩種數字不應該拿來比較。
1.這次正式發表在刺胳針期刊(Lancet)的內容是牛津疫苗第二期/第三期臨床試驗COV002其中第二期的初步結果,在英國的20間醫院收案。第二期的部分是最前面收的560人的結果,這些人還在持續追蹤中,會追蹤到一年。看他們會不會真的感染。整個第三期在英國總共收案12390人,
2.第二期是隨機單盲有對照組的收案,給予一劑或兩劑,低劑量或高劑量。從5月30日到8月8日之間總共收案560人,其中18~55歲160人(100人疫苗組,60人對照組),56~69歲160人(120人疫苗組,40人對照組),70歲以上240人(200人疫苗組,40人對照組),要看各年齡的免疫生成性還有安全性。
3.免疫生成性分為抗體免疫和細胞免疫,會用ELISA測抗體,也會用MNA80的方式測中和抗體。細胞免疫則是用 ex-vivo IFN-γ enzyme-linked immunospot assay。(這兒我就不多做解釋了…)
4.在施打兩劑之後,99%的受試者出現中和抗體。年長者也有極好的中和抗體和T細胞反應,幾乎和年輕人差不多。
5.安全性方面,常見的副作用包括了注射處疼痛,覺得發燒,頭痛,肌肉痠痛。年長組的副作用比例反而比年輕組為低。局部副作用比例:18~55歲(88%),56~69歲(73%),70歲以上(61%)。全身性反應副作用比例:18~55歲(86%),56~69歲(77%),70歲以上(65%)。
6.截至10月26日,有報告13例嚴重不良事件。研判都和疫苗無關。
04b解讀:
1.牛津第二期臨床試驗最重要的發現就是在最需要疫苗的年長者族群,不但副作用比例比年輕人低,且免疫生成性也非常好。這一點非常令人鼓舞,因為在之前的幾個第二期結果中,通常在年長者的免疫生成性都會比較差一些。
2.但實際上是否真的有保護力?就要看進行中的第三期臨床試驗的結果了。牛津疫苗的結果預期會在12月底前發表。
3.張上淳老師在11月18日記者會中有提到,疫苗一期二期臨床試驗是看免疫生成性,看產生多高的抗體,特別是多高力價的中和抗體。越高的中和抗體應該是越有可能預防感染。但這是全新的病毒,沒有足夠資料時無法認定抗體力價多高是確實有保護力的。但隨著國外第三期陸續有結果,就可以看力價高到什麼程度以後幾乎沒有人感染,界定出可預防感染的抗體力價。往後疫苗發展可以參考之前的數據,看能否達到這麼高的力價,進而決定一支疫苗夠不夠好,未必要去高風險國家做臨床試驗。以流感疫苗為例,每年季節的流感疫苗都是看接種後產生多少力價,就可判定此疫苗夠不夠好。
我上週在直播也有提到這一點。如果台灣的新冠疫苗要在2021年6月左右做完第二期就緊急授權開始施打,有效性方面,那時可能國際已經會有抗體力價的規定訂出來,這點比較沒問題。這樣就剩下安全性的問題比較擔心了,因為有些比較少見的副作用是要上萬人才能偵測出來的。不過我相信那時國際的法規會有所因應,因為全世界有超過100個新冠疫苗正在研發,每家都去花大錢做第三期臨床試驗有實際上的困難。特別是如果接下來幾個疫苗上市了,確認有有效的疫苗,照原本這樣執行對照組的第三期臨床試驗也可能會有醫學倫理的問題!
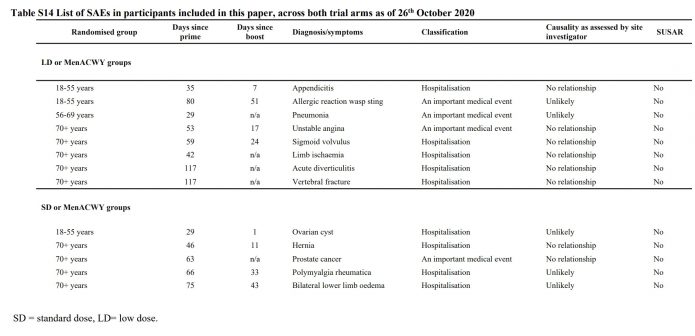
4,之前提過的橫斷性脊髓炎那個案例,還有8月也有一位神經學症狀的案例,應該是在第三期的受試者,還沒在這次報告之中。上表是在附錄中的13例嚴重不良事件,包括卵巢囊腫,盲腸炎,骨折,攝護腺癌導致住院等,研判都和疫苗無關。
延伸閱讀:
紐約時報新冠疫苗整理網頁
WHO會更新全球疫苗進度 2020.9.3
疫苗研發的臨床參考要點
BBC中文網:全球各國新冠疫苗研發進展到了什麼程度 2020.4.20
BBC中文網:新冠病毒疫苗研發賽跑 盤點全球領先衝刺臨牀的六名「選手」 2020.5.5
國產新冠疫苗拚8月人體實驗 明春施打有望 1張圖看懂台灣進度 2020.7.17
疫苗新布局:爭取牛津授權、台廠代工有望,國家隊產能為何恐受影響? 2020.8.10
歡迎追蹤前台大感染科醫師。04b的發聲管道!
希望大家當我的種子教師,推廣正確的新冠衛教。
科學防疫,不要只以恐懼防疫!
每週一9PM直播解說疫情
https://www.youtube.com/user/linshibi
加入LINE@ 訊息不漏接
https://lin.ee/3uf7fpN
Telegram也很好用喔
https://t.me/linshibi
Instagram也有喔
https://www.instagram.com/linshibi/
對這個病有較正確的認知遠比哪裡又多了案例重要!
新冠肺炎疫情下的防疫須知 常見問題解答FAQ
2019新型冠狀病毒懶人包 戴口罩勤洗手
冠狀病毒流感化?武漢肺炎疫情走向預測
新冠感染各國分年齡致死率整理 小於49歲致死率較低 小於19歲較不易染病
14天檢疫期滿後才確診?新冠潛伏期大於14天嗎?無症狀感染者的發病日和確診日?
變種病毒
英國新冠變種病毒 傳染力增加70% 英國進入第四級封鎖 新冠疫苗還有效嗎?
台灣疫情
台灣首例醫師確診新冠 傳給護理師女友 院內感染還沒到院內群聚?
部立桃園醫院院內感染群聚事件懶人包 封院?清空?
台灣本土感染案771 紐西蘭籍機師航空器群聚感染一案整理
紐約時報評台灣防疫好運可以維持多久之我見:台灣的防疫絕不是只靠運氣
日本確診一例自台灣返日之新冠病毒無症狀感染者 南部讀書的日籍女學生
比利時工程師是台灣本土感染嗎?
彰化縣萬人血清抗體篩檢懶人包 台大公衛和彰化縣衛生局合作研究
專家意見
黃立民教授 新型冠狀病毒訪問共筆
張上淳教授共筆 中央流行疫情指揮中心記者會
李秉穎老師新冠病毒訪問共筆
西班牙流感 1918年流感大流行 別小看流行性感冒!
武漢肺炎發生率與致死率的國際比較 by 陳建仁副總統
治療經驗
新型冠狀病毒 武漢肺炎 COVID-19 治療經驗分享
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯喹
瑞德西韋 remdesivir 新冠治療臨床試驗懶人包
類固醇可降低新冠重症死亡率
新冠病毒如同愛滋病毒會攻擊免疫系統?用類固醇就好了?
小心沉默的肺炎!日本自衛隊中央病院新冠治療經驗
疫苗進度
新冠疫苗進度 進入第三期臨床試驗的疫苗總整理
新冠疫苗懶人包 臨床試驗 疫苗何時會出來?
新冠疫苗爭奪戰 日本對新冠疫苗的超前佈署 台灣何時會有疫苗?COVAX會分配到什麼疫苗?
牛津疫苗懶人包:第三期臨床試驗結果整理 英國通過緊急授權
橫斷性脊髓炎是什麼?阿斯特捷利康和牛津大學合作的腺病毒新冠疫苗懶人包
莫德納(Moderna)的新冠疫苗:mRNA疫苗懶人包
輝瑞/BioNTech新冠疫苗懶人包:東洋破局 需要冷鍊的mRNA疫苗
俄羅斯史普尼克五號新冠疫苗懶人包 保護效力達92%
世界疫情
美國新冠病毒疫情懶人包
英國佛系防疫的豪賭 陳時中:目前台灣沒有到那個情況 國家醫療量能無法承擔才會這樣做
東京有抗體者僅0.1% 大阪0.17%?世界各國新冠抗體陽性率 血清盛行率整理
日本再發布緊急事態宣言 首都圈1都3縣1月8日起採取緊急事態行動
東京面臨感染爆發重大局面 東京封城?首都封鎖?
東京第二波來了嗎?新冠七指標 東京警報(Tokyo alert)彩虹大橋紅色點燈
東京新冠病毒確診單日破百 小池呼籲避免到夜生活繁華街 東京監測指標修改
東京第二波疫情來襲 小池知事發布感染擴大特別警報
通天閣太陽之塔新冠紅綠燈 大阪府知事吉村洋文推出大阪模式
大阪府知事吉村洋文推薦優碘漱口水控制新冠病毒傳播 相關商品銷售一空
沖繩新冠疫情懶人包 沖繩美軍基地群聚感染
日本武漢肺炎 新冠病毒 COVID-19流行地圖
日本旅遊回來要被隔離14天嗎?可退費嗎?何謂旅遊疫情建議等級 流行地區分級?
台灣日本南韓新冠PCR檢驗量及陽性率比較 大阪 vs 北海道
鑽石公主號郵輪新型冠狀病毒疫情懶人包 由一個香港案例傳染給至少135人的海上悲劇




東京8805間旅館比價 京都7134間旅館比價
日本訂房請參考住宿懶人包,林氏璧推薦的二十四家東京旅館,26家大阪旅館,十三家京都旅館。
訂房網站推薦Relux,e路東瀛,Booking.com,Agoda。也可先用 旅館查價網站來看是否有便宜。訂行程網站推薦KKday,KLOOK客路。
到日本上網分享器和SIM卡的問題請看過這兩篇:2023日本上網卡 SIM卡懶人包,日本行動上網分享器懶人包。
各種毒友優惠及現在的活動請見:全日本篇,東京優惠,關西京阪神優惠,九州優惠,北海道優惠,沖繩優惠。
歡迎加入林氏璧的日本自助旅遊中毒者臉書粉絲專頁,或是小狸的日本購物血拼中毒者臉書粉絲專頁,接收最新日本旅遊訊息。近期有什麼活動會在粉絲專頁置頂,LINE官方帳號:@linshibi 則會直接發送最新的優惠訊息。
RSS訂閱/ 以Email訂閱 本站,東京訊息不漏接。
本站導覽 新手第一次到本站的導覽,比較容易找到資料喔。
重要公告 即日起本部落格(包括臉書頁面/私訊/e-mail)在非公開頁面不回答日本旅遊的常見問題,請各位見諒。請一律在日本自助旅遊中毒者臉書社團中問題讓大家集思廣益。
日本/東京自助旅遊的常見問題FAQ 新手請優先閱讀。



