瑞德西韋 remdesivir 新冠治療臨床試驗懶人包


新型冠狀病毒(COVID-19,武漢肺炎)一開始沒有任何確認有效的藥物。最被期待的是未上市的新藥remdesivir(瑞德西韋),原本研發是要對付伊波拉病毒的,結果對於伊波拉病毒效果平平,但意外發現對於冠狀病毒效果很好。因此從一月開始,已經進行了一系列的臨床試驗。近來陸續有許多初步的臨床試驗發表,這篇就來整理一下瑞德西韋的臨床試驗資訊吧。有新的資訊會隨時更新!
更多新冠的藥物治療請見:
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯奎寧
羥氯奎寧用於新冠病毒治療懶人包 小心心律不整副作用!
2020.4.11:瑞德西韋(remdesivir)恩慈使用治療新冠重症患者臨床研究發表:53名重症患者36人有改善
2020.4.24:世界衛生組織在4月23日發布文件,評估瑞德西韋在中國進行的第一個臨床試驗中顯示療效不佳。
2020.4.29:更新三個臨床試驗資訊。前兩者僅是初步結果,沒有公布詳情。第三個就是24日WHO不小心洩漏的文件,正式發表在Lancet。
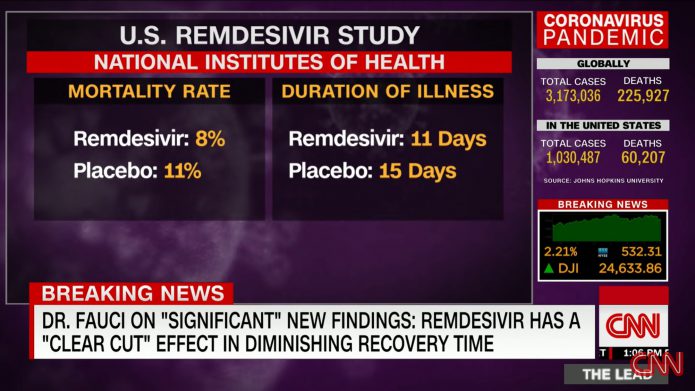
ACTT trial:美國國家過敏症和傳染病研究所(NIAID)主導,全球收案。收案1063名,用瑞德西韋患者平均康復時間為11天、死亡率8%,而對照組使用安慰劑平均康復時間為15天、死亡率11.6%。用藥組能縮短四天的病程,康復時間快了31%,很明顯達到統計學上意義(p<0.001)。死亡率則有3.6%的差別,雖然沒有統計學上差異(p=0.059),但也是8和11.6的差別,瑞德西韋組有死亡率較低的趨勢。佛奇(Anthony Fauci)醫師表示,瑞德西韋在縮短恢復時間方面具有明確、顯著、正面的作用。隨機雙盲有安慰劑的臨床試驗是實證醫學最高等級的證據,這是非常重要的第一步。這是很重要的概念驗證(proof of concept),告訴我們這個藥物可以阻斷這隻病毒,這是很樂觀的訊息。
SIMPLE trial:4月 29 日Gilead 公司發布remdesivir 的第三期臨床試驗結果,沒有對照組。收案397名新冠肺炎重症住院患者(無使用呼吸器),使用 5 天或 10 天的瑞德西韋療程效果差異不大,從10天縮短療程到5天不影響效果,且沒有安全性疑慮。多國多中心,台灣也有三家醫院參加。可以在現有藥物供應下增加一倍可以治療的人數。這在大流行的時候尤其重要,讓醫院可以治療更多亟需治療的病患。
中國武漢進行後來因為收不到案提前結束的臨床試驗,也是隨機雙盲有安慰劑對照組,收案237名重症患者,已正式發表在Lancet。瑞德西韋沒有顯著縮短康復時間,瑞德西韋組的中位康復時間為21天,安慰劑組為23天。在接受治療時症狀出現小於10天的患者群中,瑞德西韋組的康復時間快於安慰劑組,但沒達到統計學意義。本研究中有高達三分之二病患使用類固醇,個人判斷會大大影響對實驗藥物效果和安全性的觀察。甚至可以解讀為,本篇研究可能間接證實類固醇在新冠治療是有害的。這篇的治療組和對照組,還有許多基本的條件是不對等的。治療組有幾個不利因素:大於10天才治療的比例稍高(54和40%之比),高血壓糖尿病冠狀動脈心臟病的人較多。
2020.5.1:在佛奇醫師公布臨床試驗初步結果後2天,2020年5月1日,瑞德西韋已獲美國FDA緊急使用授權,可使用於治療疑似或是確診的新冠病毒疾病成人或兒童住院重症患者。新冠重症的定義是病患血氧降低(在沒有氧氣的狀態下SpO2 ≤ 94%),或需要氧氣治療,或需要呼吸器/ECMO的狀態。
2020.5.22:ACTT trial的初步結果正式發表在新英格蘭醫學雜誌NEJM(待更新)。
Remdesivir for the Treatment of Covid-19 — Preliminary Report
收案1063個病人,目前有731人完成了第29天的追蹤(瑞德西韋391人,對照組340人),因此資料還不是最完整的。還剩下301人(瑞德西韋132人,對照組169人)還沒完成,之後還會有最後的報告。
參考資料:
1.台灣衛福部 新型冠狀病毒(SARS-CoV-2)感染臨床處置暫行指引
2.美國CDC Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID-19)
3.WHO Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected

2020.4.11更新:
瑞德西韋(remdesivir)恩慈使用治療新冠重症患者臨床研究發表:53名重症患者36人有改善
4月11日在新英格蘭醫學雜誌NEJM上刊登了瑞德西韋治療新冠肺炎的臨床研究結果。
Compassionate Use of Remdesivir for Patients with Severe Covid-19
1.恩慈使用(compassionate use)係指病情危急或重大之病人,其於國內無任何可替代藥品供治療,或經所有可使用的治療仍沒有反應、疾病復發,或為治療禁忌等,而申請使用經科學性研究,但全球未核准上市之試驗用藥。
2.這篇包括了53位來自美國(22)、歐洲/加拿大(22)及日本(9)的患者。收案的標準就是需要使用氧氣的重度新冠患者。
3.給予第一天注射200mg,之後9天100mg,共10天瑞德西韋療程。之後追蹤18天。使用期間從1月5日到3月7日。
4.在53名資料充足能夠進行評估的患者中,40名(75%)接受了為期10天的治療,10名(19%)接受了5-9天的治療,3名(6%)接受治療少於5天。
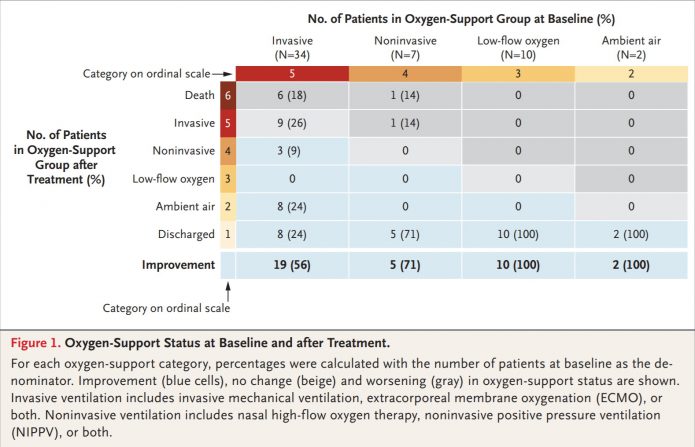
5.其中36人(68%)有看到臨床上供氧狀態的改善。包括插管接呼吸器的30人(57%)中有17例已拔管。
6.有25人(47%)出院,7人(13%)死亡,在插管接呼吸器的患者中,死亡率為18%(6/34),沒接呼吸器患者的死亡率為5%(1/19)。
7.安全性方面,有32人(60%)有報告副作用。最多的是肝功能上升,腹瀉,紅疹,腎功能異常,低血壓。12人(23%)出現嚴重副作用,其中包括多重器官衰竭、敗血性休克、急性腎臟損傷和高血壓。(這裡較難確認這些副作用是藥物本身造成的還是病毒本身或是其他藥物造成的,這需要更多臨床試驗的數據)
8.結論:瑞德西韋治療重症患者,68%的患者氧氣得到改善,中位追蹤時間18天時的總死亡率為13%。
04b解讀:瑞德西韋這個藥物很有趣,原本是針對伊波拉病毒開發的藥物,臨床試驗效果不佳,後來發現反而對冠狀病毒療效很好,比方說SARS,MERS病毒,還有現在的新冠病毒。
此恩慈療法中將近七成的人可以看到臨床的改善是很不錯的數字,特別是插管的病患能有57%拔管,死亡率壓到18%,總死亡率13%。之前在中國的較大型研究中,重症患者的死亡率在17-78%之間不等。一項在武漢進行201名患者的研究中,接受插管患者的死亡率高達66%(44/67)。英國的重症患者,死亡率將近一半。因此這13%算是很不錯的結果。
張P在4月11日記者會上回應此臨床試驗表示:瑞德西韋是到目前為止最有機會有療效的藥物。
不過當然更確認的療效還有完整的副作用評估需要等大型臨床試驗發表,有治療組還有對照組兩相比較才會更清楚。預期在四月底會有機會看到。
2020.4.24更新:世界衛生組織(WHO)在4月23日發布文件,評估瑞德西韋在中國進行的第一個臨床試驗中顯示療效不佳。WHO表示此報告還在同儕審查,因為處理錯誤而不小心提早發布,發現後就被立刻下架。
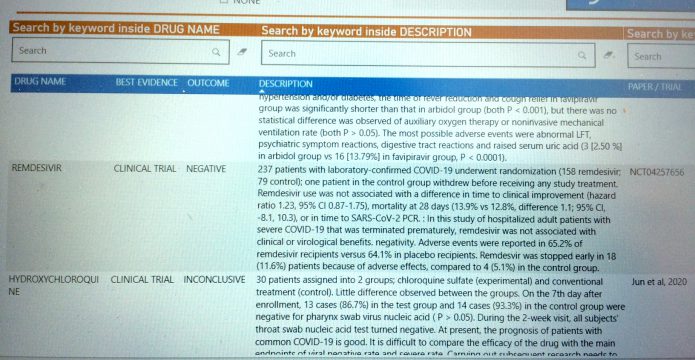
報告指出,此臨床試驗NCT04257656收案237名患者,158人使用瑞德西韋,79人為對照組。不論是到臨床改善的時間,28天的死亡率(5治療組13.9%,對照組12.8%)還有以PCR測不到病毒的時間,三者都沒有達到統計學的意義。在這個提前終止收案的臨床試驗中,沒有看到瑞德西韋在臨床上還有病毒消除上有好處。有回報副作用的比例方面,治療組65.2%,對照組64.1%。瑞德西韋組有18名患者(11.6%)因為副作用而提前終止用藥,對照組則只有4人(5.1%)。

吉立亞醫藥公司(Gilead Sciences Inc)則發表聲明,這份意外露出的報告對於該研究的解讀是不適當的。該研究因為收案數不足所以提早終止,無法形成在統計學上有意義的結論。有部分結果顯示瑞德西韋有潛在的好處,特別是提早開始治療的病患。更詳細的資料已經投稿正在經過同儕審查,近期內就會有更詳盡的資訊供大家參考。(2020.5.1更新:已經正式發表在Lancet,後面有提到了)
04b解讀:
1.在中國進行的兩個瑞德西韋臨床試驗,一個輕症一個重症,都因為無法收到預期的人數(各自約需收案400多人),而在四月中被提前終止。今天露出的這個是重症的那個臨床試驗的初步結果。
2.這個臨床試驗是隨機雙盲的,也就是受試者和醫師都不知道給的藥是安慰劑還是瑞德西韋。講究實證醫學的現代,隨機雙盲的臨床試驗是最可信的研究方法。
3.臨床試驗要做出有統計學意義的結果,需要一定的收案數。此案聲稱是因為收案人數不足而提前終止,其實也已經收到一半了,從現在看到的數據看來無疑會令人失望,因為就算沒有達到統計學意義,但應該多少看得出一些好處。(如同之前愛滋藥物Kaletra的結果)
4.還需要仔細審視此案更詳細的資料,才能更精確的解讀,比方說兩個組別的疾病嚴重程度,年齡慢性病等基本資料上是否有差別等等。
5.解盲後,發現瑞德西韋組有18名患者(11.6%)因為副作用而提前終止用藥,對照組則只有4人(5.1%)。這滿令人擔心的。當然還要去詳細看各自是因為什麼原因而停藥才能更清楚。
6.目前全世界還有四個瑞德西韋臨床試驗正在收案中,台灣有三家醫院參加,分別是台大醫院,中國附醫,高雄榮總。台灣有限的案例中,張P曾說過目前國內已有10人先後用藥,其中有一位患者接受治療後,方可脫離呼吸器,其餘個案也都維持得不錯。也只能希望後續的臨床試驗能有好結果了。
報導:
New data on Gilead’s remdesivir, released by accident, show no benefit for coronavirus patients. Company still sees reason for hope
武漢肺炎抗病毒藥物瑞德西韋 傳首次臨床試驗失敗
WHO爆「瑞德西韋」首次試驗失敗 吉立亞發聲明駁斥
2020.4.30更新:這幾天連續有三個關於瑞德西韋的進展。前兩者僅是初步結果,沒有公布詳情。第三個就是之前提過的WHO不小心洩漏的在中國提前中止的臨床試驗。正式出版在Lancet。張P今天記者會提到第2和第3個。
A. Adaptive COVID-19 Treatment Trial (ACTT) ACTT trial,NCT04280705
出處:NIH Clinical Trial Shows Remdesivir Accelerates Recovery from Advanced COVID-19
美國國家過敏症和傳染病研究所(NIAID)主導,全球收案,NIAID新聞稿公布,宣稱近期將正式發表。
執行地點:多國多中心,68家醫院,包括47家在美國,21家在歐洲和亞洲。
臨床試驗驗設計:隨機雙盲有安慰劑對照組 randomized, double-blind, placebo-controlled trial
收案條件:發病任何時間皆可,並有以下任一狀況:胸部影像上有肺炎,血氧小於94%,須要用氧氣,或是需要呼吸器。
Radiographic infiltrates by imaging (chest x-ray, CT scan, etc.), OR
SpO2 < / = 94% on room air, OR
Requiring supplemental oxygen, OR
Requiring mechanical ventilation
治療組:注射瑞德西韋10天。
對照組:注射安慰劑10天。
主要療效指標(primary endpoint):康復時間,定義:住院患者進步到不需要氧氣甚至出院的時間。
收案時間:2020年2月21日~4月19日
結果:
1.總計收案1063名,用瑞德西韋患者平均康復時間為11天、死亡率8%,而對照組使用安慰劑平均康復時間為15天、死亡率11.6%。用藥組能縮短四天的病程,康復時間快了31%,很明顯達到統計學上意義(p<0.001)。死亡率則有3.6%的差別,雖然沒有統計學上差異(p=0.059),但也是8和11.6的差別,瑞德西韋組有死亡率較低的趨勢。離統計學有差異的小於0.05,其實也很接近了。如果收案人數更多,應該就有機會達到有統計學上的意義。
2.美國國家過敏和傳染病研究所的負責人,佛奇(Anthony Fauci)醫師表示,瑞德西韋在縮短恢復時間方面具有明確、顯著、正面的作用。隨機雙盲有安慰劑的臨床試驗是實證醫學最高等級的證據,這是非常重要的第一步。雖然31%的改善,看起來不是一個神藥等級的效果(例如100%那種),但這是很重要的概念驗證(proof of concept),告訴我們這個藥物可以阻斷這隻病毒,這是很樂觀的訊息。
3.佛奇醫師進一步指出,為何他會在此刻就公布這個結果(詳細資訊尚未正式發表,還有些資料還在清),是因為任何時候你有非常確切的證據一個原本無藥可醫的病有藥物可治療,你有醫學倫理上的義務需要讓所有人知道這件事,因為這將會變成醫療上的標準治療。所以目前進行中的臨床試驗,如果是完全沒有給治療的對照組別,可能要考慮調整加入標準治療。
4.佛奇說,在他檢視這份報告時,他想起了1986年,當年沒有任何對愛滋病毒有效的藥物。當時NIH做了AZT這個藥物的臨床試驗,證明有中等的療效。後來有更多不同機轉的藥物出現,我們開始用合併治療,而演變為目前熟知的雞尾酒治療。這只是一個開始,我們有能力治療這個病毒,我們會開始看藥物合併治療會不會有更好的效果。
04b解讀:
1.這個臨床試驗是隨機雙盲的,也就是受試者和醫師都不知道給的藥是安慰劑還是瑞德西韋。講究實證醫學的現代,隨機雙盲的臨床試驗是最可信的研究方法。此臨床試驗收案高達1063人,人數已經非常多。可以下非常有意義的結論。
2.我個人是偏向於樂觀看待的。此實驗設計上要看到的主要療效指標(primary endpoint):患者平均康復時間(Time to recovery),從15天變成11天,非常顯著。你會覺得這4天沒什麼嗎?不,這31%的加速恢復很重要。病人治療時間可以減少31%,就意味可以增加31%的占床和使用呼吸器的時間。這可以在社區大爆發時讓醫院多治療31%的病人,更不容易導致醫療崩潰。
3.大家熟知的藥物:克流感( oseltamivir)的效用,Lancet曾發表一篇整合分析,九個臨床試驗共4328個患者中,克流感可以讓症狀改善時間從122.7小時減少到97.5小時,時間減少21%。當然新冠這篇是中重症看的是缺氧狀態的恢復,克流感則是輕症看的是症狀恢復。不過就是給大家個概念,抗病毒藥能有個31%的加速恢復算是不錯的結果了。
4.死亡率從11.6%降到8%當然也是值得注意的。全球目前已經有20萬人死於新冠病毒,如果都能用藥,等於是可以減少6萬人的死亡。雖說沒達到統計學意義的結果,但如果收案更多人的話,很可能就會拉出統計學上的意義了。這趨勢看起來是明顯的。
5.值得注意的是,這個臨床試驗沒有限定收重症而已,中重症皆可。其他兩篇都是收重症,就是血氧SpO2 <94%。此外開始治療的時間點也非常重要,這整個研究細節還沒公佈。可能還要看治療的時間點,輕重症的比例才能更正確的解讀。
6.看整個臨床試驗的設計,似乎沒有探討病毒從呼吸道消失的時間是否會縮短。不過現在選的觀察指標:臨床的恢復,還有14天和29天的死亡率,都是更重要實際的療效指標了。
7.要不是有前面中國臨床試驗失敗的陰影,這個美國國家衛生研究院主導的ACTT臨床試驗,應該會讓所有人歡欣鼓舞。但前面不管是羥氯奎寧的後續或是中國那個臨床試驗,讓醫界不要這麼興奮而持較謹慎的態度來審視這些臨床試驗結果,我覺得是好事。
8.沒有意外的話,美國FDA應該會據此研究結果通過瑞德西韋的緊急授權使用於治療新冠病毒感染。

B.Study to Evaluate the Safety and Antiviral Activity of Remdesivir (GS-5734™) in Participants With Severe Coronavirus Disease (COVID-19) SIMPLE trial,NCT04292899
出處:Gilead Announces Results From Phase 3 Trial of Investigational Antiviral Remdesivir in Patients With Severe COVID-19
— Study Demonstrates Similar Efficacy with 5- and 10-Day Dosing Durations of Remdesivir —
4月 29 日Gilead 公司發布remdesivir 的第三期臨床試驗結果。新冠肺炎重症住院患者使用 5 天或 10 天的瑞德西韋療程效果差異不大,從10天縮短療程到5天不影響效果,且沒有安全性疑慮。Gilead 公司表示將把試驗結果在下週投稿同儕審核的期刊。
全球收案,比較5天和10天療程。吉立亞醫藥公司在官網公布,宣稱近期將出版。
執行地點:多國多中心,台灣也有三家醫院參加
臨床試驗驗設計:開放性,無安慰劑,無對照組 Parallel Assignment, Open Label, 臨床3期
收案條件:住院患者,血氧小於94%或須要用氧氣,需要呼吸器組使用呼吸器不可超過5天。
原本預計收案400位不使用呼吸器患者,於4月16日更改要收案到6000人,且會納入呼吸器的病患。
治療組1:注射瑞德西韋5天。
治療組2:注射瑞德西韋10天。
主要療效指標(primary endpoint):第14天時康復的比例,定義:住院患者進步到不需要氧氣甚至出院。
根據改善情況給予 1~7 的不同分數,狀態包含了死亡、需要增加氧氣支持,或到無需氧氣支持與醫療照護的康復出院。
收案時間:2020年3月6日~
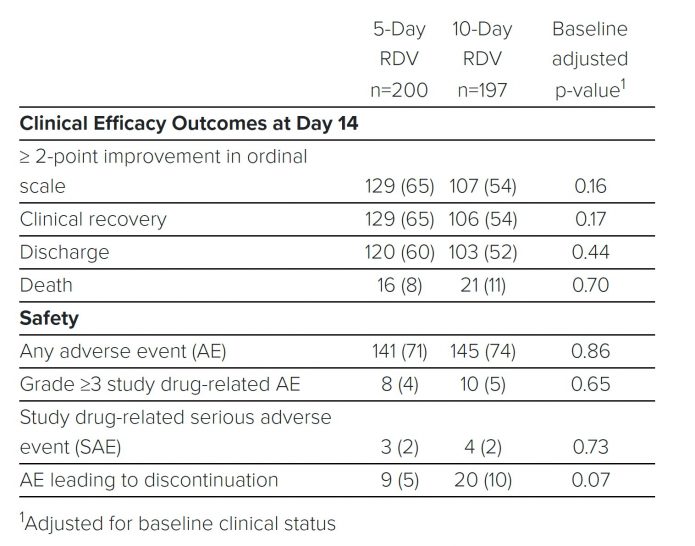
結果:
1.收案397名重症患者, 5 天療程和 10 天療程兩組讓一半的患者康復時間分別是10 天和 11 天,而在第 14 天兩組臨床改善比例為64.5%和53.8% (5-day: 64.5%, n=129/200 vs.10-day: 53.8% n=106/197; p=0.17 ),出院比例為60%和52.3% (5-day: 60.0%, n=120/200 vs.10-day: 52.3% n=103/197; p=0.44)。死亡率則各自是8%和11%,瑞德西韋在兩者中的治療成效無太大差異,都沒有到統計學上意義的差別。
2.副作用方面,還算耐受良好,兩組產生第三級以上可能是藥物相關的副作用比例是8位(4%)和10位(5%)。因為副作用而停藥者,在5天的患者有9位(5%),在10天的患者有20位(10%)。雖然統計學上無意義,但似乎十天組比例較高(p=0.07)。最常見的副作用是噁心 (5-day: 10.0%, n=20/200 vs. 10-day: 8.6%, n=17/197) 還有急性呼吸衰竭 (5-day: 6.0%, n=12/200 vs. 10-day: 10.7%, n= 21/197)。有7.3%(n=28/385)的病人發生第三級以上的肝功能上升,有12人(3%)因此而停藥。
3.判定是瑞德西韋相關的嚴重副作用(SAE)在兩組各自是3位(2%)和4位(2%)。目前新聞稿沒有寫是怎樣的副作用。
4.臨床預後也和地理區域有關。在義大利以外,14天的死亡率是7%(n=23/320),在第 14天臨床改善比例為64%(n=205/320),出院比例為61%(n=196/320)。
5.試著分析發病10天內和10天後給藥的兩群人,在第14天出院比例分別是62%和49%。早期接受治療似乎效果較佳。
6.吉立亞醫藥公司的首席醫療長Merdad Parsey表示:和傳統的藥物研發不同,我們試著在這全球疫情中評估此試驗藥物。許多同時進行的研究可以回答瑞德西韋到底是不是安全而有效的藥物,還有如何去使用他。SIMPLE trial這個 3 期臨床試驗補足了國家過敏和傳染病研究所的ACTT trial實驗結果,告訴我們有些病患5天的療程是可以的,可以在現有藥物供應下增加一倍可以治療的人數。這在大流行的時候尤其重要,讓醫院可以治療更多亟需治療的病患。
7.吉立亞的這個SIMPLE trial近期將擴大試驗參與人數到6000名患者(再加5400人),於全球 180家醫院收案,這次就會收治有呼吸器的患者。此外還有收治中等嚴重度的另一個SIMPLE trial臨床試驗,這大約會收案600人,預期在五月底公布結果。
04b解讀:
1.這個SIMPLE trial臨床試驗沒有對照組,醫師患者都知道自己是在哪個治療組,請注意這可能造成的限制。比方說在10日的組別中,發生的副作用相對於5日組可能更容易被判定為和實驗用藥有關。
2.要注意這篇和前面提的ACTT trial一樣現在都還只有新聞稿,詳細的資料都還沒公佈。一樣可能還要看兩組治療的時間點,疾病嚴重度,重症高風險因子的比例才能更正確的解讀。
3.如果兩組可能影響預後的因子分配都差不多,5 天療程和 10 天療程效果差不多的結論當然是好事,病患使用5天即可,醫院就可以治療更多病患,病患本身用藥產生副作用的機率也可能降低。
4.症狀出現 10 天內治療效果較佳,這個結論不讓人意外,多半感染症的臨床試驗都顯示越早治療效果最好。大家熟知的抗流感藥物:克流感( oseltamivir)的效用就是在發病後48小時之內使用最有效。
5.目前瑞德西韋看來最要注意的副作用應該是肝功能上升。有慢性肝病的病患或是併用其他可能傷肝藥物時要非常注意。

C.A Trial of Remdesivir in Adults With Severe COVID-19 NCT04257656
出處:Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial
評論:Remdesivir for COVID-19: challenges of underpowered studies
之前WHO不小心洩漏的瑞德西韋在中國進行的那個提前中止的臨床試驗。正式發表在Lancet。
收案237名重症患者,158人使用瑞德西韋,79人為對照組。
執行地點:中國湖北省的10家醫院
臨床試驗驗設計:隨機雙盲有安慰劑對照組 randomized, double-blind, placebo-controlled trial
收案條件:發病12天內,胸部影像上有肺炎,血氧小於94%
Lung involvement confirmed with chest imaging
Hospitalized with a SaO2/SPO2≤94% on room air or Pa02/Fi02 ratio <300mgHg
≤12 days since illness onset
治療組:注射瑞德西韋10天。
對照組:注射安慰劑10天。
主要療效指標(primary endpoint):康復時間,定義:住院患者進步到下降2分的天數。
根據臨床狀態給予 1~6 的不同分數,包括死亡6分,住加護病房需要呼吸器或ECMO 5分,住院需要非侵襲式呼吸器 4分,住院需要氧氣 3分,住院不需氧氣2分,出院1分。
收案時間:2020年2月6日~3月12日
結果:
1.總計收案237名重症患者,以2:1的比例隨機分派組別,158人使用瑞德西韋,79人為對照組給予安慰劑。
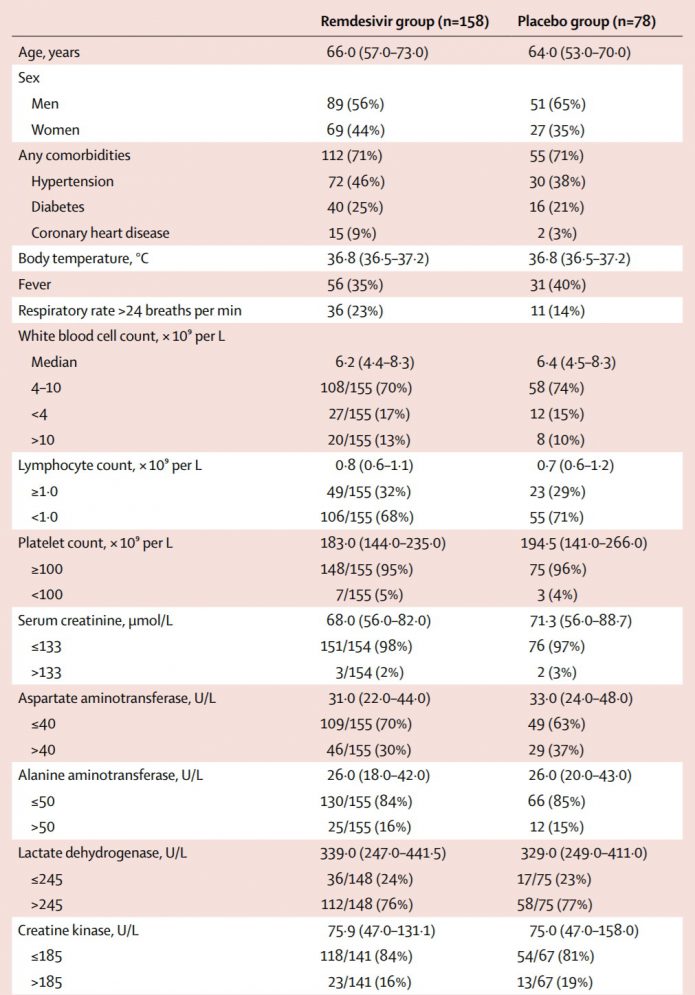
2.治療組和對照組,有些基本的條件是不對等的。原本有慢性病包括高血壓的比例(46%,38%),糖尿病的比例(25%,21%),冠狀動脈心臟病的比例(9%,3%),似乎都是治療組稍高。
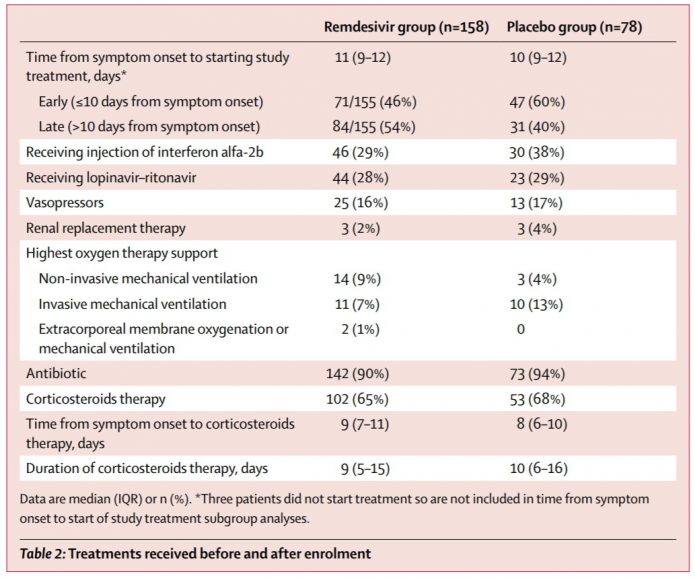
3.治療組大於10天才治療的比例稍高(54和40%之比)。對於同時用藥沒有多加限制,病患可以用其餘有機會有效的抗病毒藥物,包括抗愛滋病毒用藥 lopinavir–ritonavir,干擾素,也允許使用類固醇。兩組使用干擾素的比例(29%,38%),使用抗愛滋病毒用藥的比例(28%,29%),還有使用類固醇的比例(65%,68%)差不多。
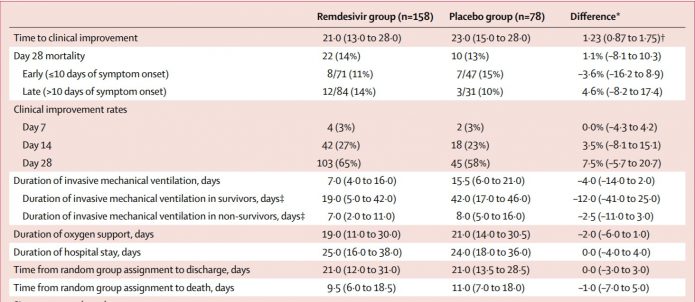
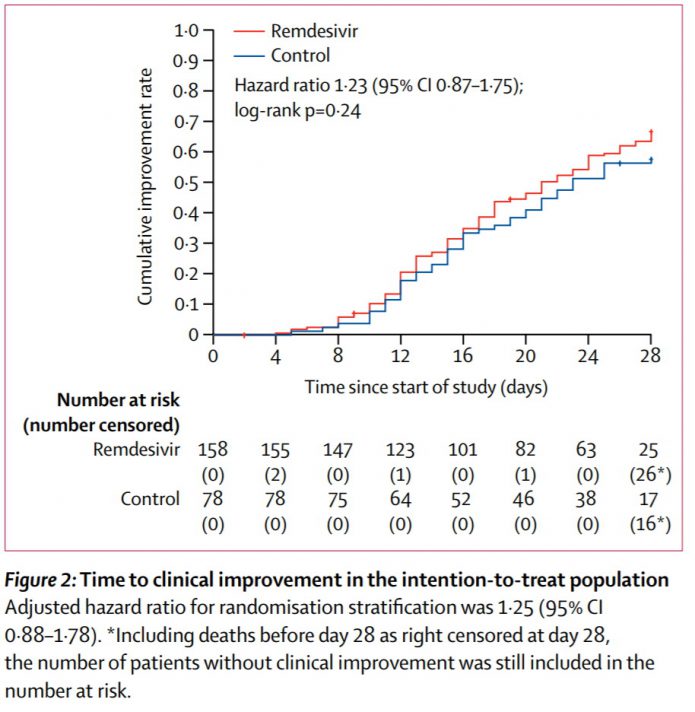
4.用瑞德西韋患者康復時間為21天、死亡率14%,而對照組使用安慰劑平均康復時間為23天、死亡率13%。瑞德西韋沒有顯著縮短康復時間 (hazard ratio 1·23 [95% CI 0·87–1·75]),兩組28日死亡率也差不多。
5.在接受治療時症狀出現小於10天的患者群中,瑞德西韋組的康復時間快於安慰劑組,但沒達到統計學意義 (hazard ratio 1·52 [0·95–2·43])。此案宣稱因為後來收不到案,由於收案數不足就結束了,是否早期治療能有好處,這還需要更大規模的研究來確認。
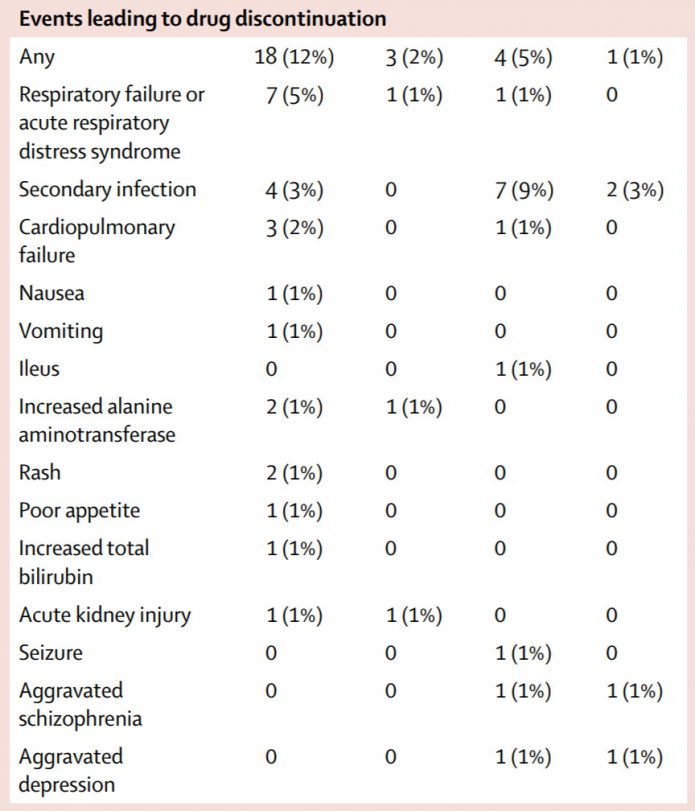
6.副作用方面,瑞德西韋組有102人 (66%) 有報告副作用發生,對照組則有50人 (64%)。瑞德西韋組有18人 (12%) 因為副作用而提早停藥,對照組則有4人 (5%)。瑞德西韋組中有高達7人 (5%)是因為發生了呼吸衰竭或急性呼吸窘迫症候群(ARDS)而停藥。
04b解讀:中國提早中止的瑞德西韋臨床試驗
是證明了瑞德西韋無效,還是證明了類固醇有害?
這篇比較長,詳細資訊我稍晚再整理,但我讀完最大的疑問是,為什麼他們用了這麼多類固醇呀…..
1.這篇的治療組和對照組,有許多基本的條件是不對等的,有可能影響結果。治療組有幾個不利因素:大於10天才治療的比例稍高(54和40%之比),高血壓糖尿病冠狀動脈心臟病的人較多。

1.有高達三分之二(65,68%)的人用了類固醇,平均使用9~10天

2.台灣和美國目前的新冠治療指引,都不建議常規使用類固醇。主因是因為病毒碰到類固醇學理上可能繁殖的更快,而根據之前病毒性肺炎的經驗,都不建議使用類固醇。以下是台灣治療上所描述之前的研究發現:
SARS:不會增加存活率,但可能產生併發症,延緩病毒清除。
流感:死亡和續發感染的風險更高。
MERS:不會增加存活率,但延緩下呼吸道病毒清除。

3.美國感染症醫學會的新冠治療指引在類固醇的使用一節,有提到中國會廣泛使用類固醇來預防進展為急性呼吸窘迫症候群(ARDS)。但目前的四篇研究中,有種種問題,無法下確切結論。此外根據SARS和MERS的15篇研究經驗,並無法證明使用類固醇的好處,反而可能會讓病毒清除被延緩。(在胸腔科領域,比較多的證據是在ARDS後,預防之後會發生的肺纖維化)

4.研究了一下,中國的確會在幾種狀況下使用類固醇。比方說,這是馬雲基金會請浙江大学医学院附属第一医院寫的治療指引。這些是有提到類固醇的部分。

5.作者在文中討論部分,提及本研究的限制,也有承認他們的病人中頻繁的使用類固醇可能會促進病毒繁殖,就像在SARS和MERS中觀察到的。雖然那些研究只是報導到延長偵測到病毒的RNA,而不是活的有感染力的病毒。
The frequent use of corticosteroids in our patient group might have promoted viral replication, as observed in SARS and MERS,
although these studies only reported prolongation of the
detection of viral RNA, not infectious virus.
6.我相信全世界其他國家,應該用類固醇的比例沒有這麼高。前面提的ACTT trial 還有SIMPLE trial,目前僅有新聞稿,等詳細資料出來,希望也會有用類固醇比例的資料。這兩個臨床試驗用瑞德西韋組28天死亡率都是8~11%左右,中國這篇則是14%。
7.瑞德西韋組有18人 (12%) 因為副作用而提早停藥,對照組則有4人 (5%)。但詳細審視,瑞德西韋組中有高達7人 (5%)是因為發生了呼吸衰竭或急性呼吸窘迫症候群(ARDS)而停藥。對照組則僅有1人 (1%)。但這我不明白,在用藥中呼吸衰竭可能是表示此藥治療無效而停用。但不應該視為這是藥物造成的副作用。且這是一個目前還沒有確認治療的疾病,正在測試藥物的效果,就算發生了呼吸衰竭,為何不繼續用藥下去?因為也沒有別的藥可以換呀。
我初步的感想是,這篇用了這麼多類固醇,高達三分之二,有可能嚴重的影響對實驗藥物效果和安全性的觀察。甚至可以解讀為,本篇研究可能間接證實類固醇在新冠治療是有害的。作者在第5點的辯護不夠,應該要把沒有類固醇和有用類固醇的案例也分析看看。不過當然這兩組很可能基本的疾病嚴重度就不同,也看不出所以然。
另外,這篇的治療組和對照組,還有許多基本的條件是不對等的。治療組有幾個不利因素:大於10天才治療的比例稍高(54和40%之比),高血壓糖尿病冠狀動脈心臟病的人較多。
總之,下個結論吧。
一句話講完。我對瑞德西韋的療效是樂觀看待的!
最好早些使用,開始症狀前10天內,氧氣一有下降跡象就要趕快使用。不要到重症才使用。另外可能用5天的療程就夠了。要小心肝功能異常的副作用。
2020.5.2更新:在佛奇醫師公布臨床試驗初步結果後2天,2020年5月1日,瑞德西韋已獲美國FDA緊急使用授權,可使用於治療疑似或是確診的新冠病毒疾病成人或兒童住院重症患者。新冠重症的定義是病患血氧降低(在沒有氧氣的狀態下SpO2 ≤ 94%),或需要氧氣治療,或需要呼吸器/ECMO的狀態。
根據緊急使用授權的條款還有目前已有的科學證據,FDA相信瑞德西韋可能對新冠病毒疾病是有效的。也因為目前還沒有任何其他的治療,治療這個嚴重或威脅生命病毒的可能好處大過了瑞德西韋已知或是潛在的副作用風險。
FDA還提供了常見問題。如下:
1.什麼是緊急使用授權(Emergency Use Authorization,EUA)?
答:在某些公共衛生的緊急狀態,FDA可以批准緊急使用授權讓一些還沒有上市的藥物,診斷試劑,疫苗,醫材等等用於診斷,治療或預防嚴重的疾病。這些授權的製品還沒有被FDA正式批准上市,FDA要決定是否用這些製品的好處大於風險。這並不是FDA的正式批准。
2.瑞德西韋的緊急使用授權允許了什麼呢?
答:緊急使用授權讓藥廠可以分派瑞德西韋到醫院,提供醫療人員去治療疑似或是確診的新冠病毒疾病成人或兒童住院重症患者。新冠重症的定義是病患血氧降低(在沒有氧氣的狀態下SpO2 ≤ 94%),或需要氧氣治療,或需要呼吸器/ECMO的狀態。
3.瑞德西韋已經被FDA批準去治療新冠了嗎?
答:不,瑞德西韋是一個新抗病毒藥,還沒有被FDA批准去治療或預防任何疾病,包括新冠。
4.現有資料顯示瑞德西韋可能對新冠病患有療效嗎?
答:在體外實驗顯示瑞德西韋可以殺死新冠病毒。美國國家過敏症和傳染病研究所(NIAID)主導隨機雙盲有安慰劑對照組的臨床試驗ACTT trial初步報告顯示,瑞德西韋可以康復的比較快。另一個第三期臨床試驗SIMPLE trial則顯示5天和10天的療程效果差不多,但多半收案沒有使用呼吸器。瑞德西韋的安全性和療效還在許多進行中的臨床試驗評估中。
5. 有什麼樣的臨床試驗正在進行呢?
答:接下來可能會針對特定族群進行試驗,包括腎功能有問題的患者,或是和其他藥物併用。
6.瑞德西韋有什麼可能的副作用?
答:可能的副作用包括:
肝功能異常,這些指數上升可能代表肝臟細胞的發言或是受傷害。
注射相關的反應,通常發生在注射同時或是注射完之後,包括血壓降低,噁心,嘔吐,流汗,發抖。
不只以上副作用。瑞德西韋是還在研究中的新藥,因此可能還有未知的風險。
7.如果發生了副作用,是否需要通報?
答:是的,這是在緊急使用授權中的一部分。FDA要求醫療提供者要報告所有用藥錯誤或是所有可能和瑞德西韋相關的嚴重副作用。
8.在緊急使用授權之下,如何能獲得此藥?
答:美國政府會根據緊急使用授權的規定,控制瑞德西韋的配送。藥廠會供應給授權的提供廠商,或是直接給政府單位,由此兩者配送給各醫院使用。
報導:
BBC中文網:「神藥」瑞德西韋臨牀試驗中美得出相反結論,全球專家分析原因

2020.5.22:ACTT trial的初步結果正式發表在新英格蘭醫學雜誌NEJM。
Remdesivir for the Treatment of Covid-19 — Preliminary Report
我先說結論,拿這個臨床試驗中的134個亞洲人的資料來說瑞德西韋對於亞洲人沒效,是不適當的解讀。我們還沒有完整證據說這樣的結論。
美國國家過敏症和傳染病研究所(NIAID)主導,全球收案。
執行地點:多國多中心,68家醫院,包括47家在美國,21家在歐洲和亞洲。
臨床試驗驗設計:隨機雙盲有安慰劑對照組 randomized, double-blind, placebo-controlled trial
收案條件:發病任何時間皆可,並有以下任一狀況:胸部影像上有肺炎,血氧小於94%,須要用氧氣,或是需要呼吸器。
Radiographic infiltrates by imaging (chest x-ray, CT scan, etc.), OR
SpO2 < / = 94% on room air, OR
Requiring supplemental oxygen, OR
Requiring mechanical ventilation
治療組:注射瑞德西韋10天。
對照組:注射安慰劑10天。
主要療效指標(primary endpoint):康復時間,定義:住院患者進步到不需要氧氣甚至出院的時間。
收案時間:2020年2月21日~4月19日
結果:
1.總計收案1063個病人,目前有731人完成了第29天的追蹤(瑞德西韋391人,對照組340人),因此資料還不是最完整的。還剩下301人(瑞德西韋132人,對照組169人)還沒完成所有的追蹤,之後還會有最後的報告。
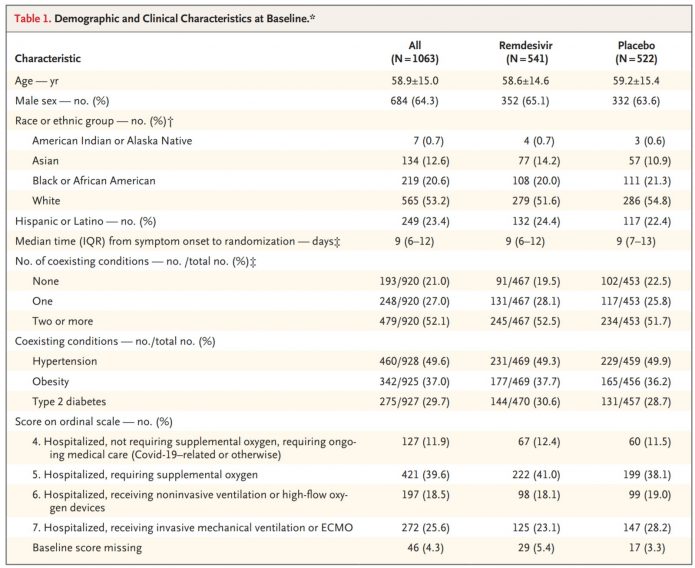
2.兩組病患共1063個病人中,瑞德西韋組541人,對照組522人。兩組的基本資料大致相同,包括性別,人種分布,從有症狀到收案的時間,有慢性病包括高血壓,肥胖還有糖尿病的比例,還有一開始的疾病嚴重程度(以須不須要氧氣或呼吸器等來分級,分別是4~7分)。
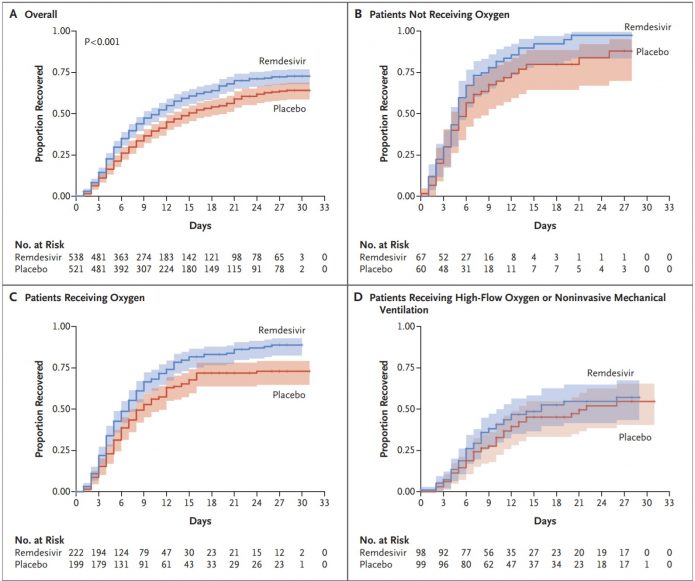
3.用瑞德西韋患者平均康復時間為11天,而對照組使用安慰劑平均康復時間為15天。用藥組能縮短四天的病程,康復時間快了31%,很明顯達到統計學上意義(p<0.001)。(rate ratio for recovery, 1.32; 95% CI, 1.12 to 1.55; P<0.001)
A圖是全部病患,BCD是疾病嚴重程度4~6分拉出來看,
嚴重程度4:病患不須要氧氣。
嚴重程度5:病患須要氧氣。
嚴重程度6:病患須要高流量氧氣或是非侵入式的呼吸器(尚不須插管)。
可以看出在嚴重程度5,兩條線都還是明顯的拉開。但嚴重程度4和6就拉不太開了。這應該是因為嚴重程度5人數最多,另外兩者人數較少的關係。
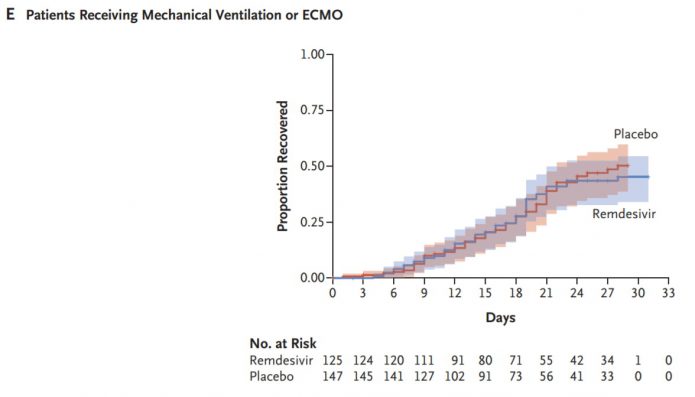
4.最後E圖是嚴重程度7:兩條線也是沒有拉開。綜合以上,似乎是在嚴重度5以下,比較輕症還沒有進展到需要呼吸器的病患就使用,才比較有效果。
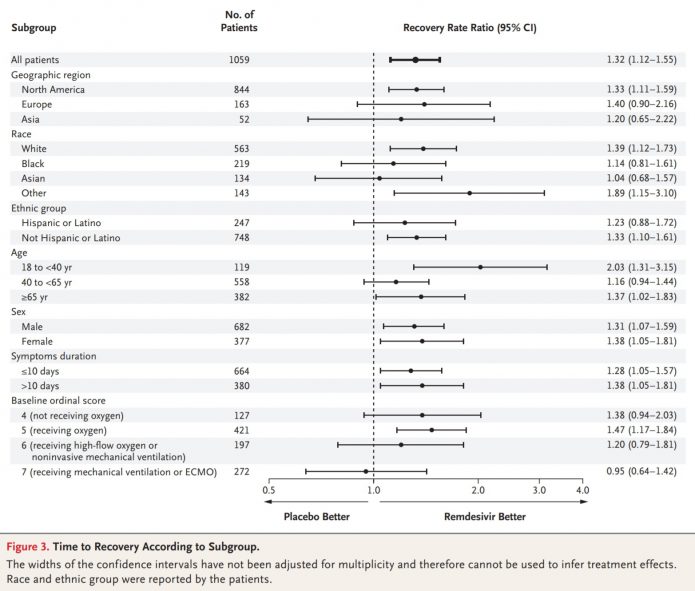
5.這個表是亞組分析(Subgroup analysis),就是嘗試對臨床試驗其中部分研究對象(亞組)進行分析。但表中說明有提到,這個結果還沒有經過多變數的調整,所以不應該用於解讀治療效果。就是僅供參考的意思。
6.這個初步報告是獨立的資料與安全監測委員會(DSMB)4月27日看了到4月22日之前的試驗結果。當時已經有了482人恢復還有82人死亡,這超過了當初估計須要統計可以發生意義的數字。當時DSMB就建議這初步報告應該要告知執行單位NIAID,和前述佛奇之所以在5月7日在白宮記者會先公布的原因類似,因為瑞德西韋的療效已經非常明顯,對於還在此臨床試驗中的病患還有其他世界上的新冠病患而言,都有立即的重要性要讓他們知道。(有醫學倫理上的義務需要讓所有人知道這件事。)
04b解讀:
1.這個臨床試驗是隨機雙盲的,也就是受試者和醫師都不知道給的藥是安慰劑還是瑞德西韋。講究實證醫學的現代,隨機雙盲的臨床試驗是最可信的研究方法。此臨床試驗收案高達1063人,人數已經非常多。可以下非常有意義的結論。
2.我個人是偏向於樂觀看待的。此實驗設計上要看到的主要療效指標(primary endpoint):患者平均康復時間(Time to recovery),從15天變成11天,非常顯著。你會覺得這4天沒什麼嗎?不,這31%的加速恢復很重要。病人治療時間可以減少31%,就意味可以增加31%的占床和使用呼吸器的時間。這可以在社區大爆發時讓醫院多治療31%的病人,更不容易導致醫療崩潰。
3.大家熟知的藥物:克流感( oseltamivir)的效用,Lancet曾發表一篇整合分析,九個臨床試驗共4328個患者中,克流感可以讓症狀改善時間從122.7小時減少到97.5小時,時間減少21%。當然新冠這篇是中重症看的是缺氧狀態的恢復,克流感則是輕症看的是症狀恢復。不過就是給大家個概念,抗病毒藥能有個31%的加速恢復算是不錯的結果了。
4.死亡率從11.6%降到8%當然也是值得注意的。全球目前已經有20萬人死於新冠病毒,如果都能用藥,等於是可以減少6萬人的死亡。雖說沒達到統計學意義的結果,但如果收案更多人的話,很可能就會拉出統計學上的意義了。這趨勢看起來是明顯的。
5.值得注意的是,這個臨床試驗沒有限定收重症而已,中重症皆可。其他兩篇都是收重症,就是血氧SpO2 <94%。此外開始治療的時間點也非常重要,這整個研究細節還沒公佈。可能還要看治療的時間點,輕重症的比例才能更正確的解讀。
6.看整個臨床試驗的設計,似乎沒有探討病毒從呼吸道消失的時間是否會縮短。不過現在選的觀察指標:臨床的恢復,還有14天和29天的死亡率,都是更重要實際的療效指標了。
7.要不是有前面中國臨床試驗失敗的陰影,這個美國國家衛生研究院主導的ACTT臨床試驗,應該會讓所有人歡欣鼓舞。但前面不管是羥氯奎寧的後續或是中國那個臨床試驗,讓醫界不要這麼興奮而持較謹慎的態度來審視這些臨床試驗結果,我覺得是好事。
更多新冠的藥物治療請見:
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯奎寧
羥氯奎寧用於新冠病毒治療懶人包 小心心律不整副作用!
延伸閱讀:對這個病有較正確的認知遠比哪裡又多了案例重要!
新冠肺炎疫情下的防疫須知 常見問題解答FAQ
2019新型冠狀病毒懶人包 戴口罩勤洗手
冠狀病毒流感化?武漢肺炎疫情走向預測
新冠感染各國分年齡致死率整理 小於49歲致死率較低 小於19歲較不易染病
英國佛系防疫的豪賭 陳時中:目前台灣沒有到那個情況 國家醫療量能無法承擔才會這樣做
專家意見
黃立民教授 新型冠狀病毒訪問共筆
張上淳教授共筆 中央流行疫情指揮中心記者會
李秉穎老師新冠病毒訪問共筆
西班牙流感 1918年流感大流行 別小看流行性感冒!
武漢肺炎發生率與致死率的國際比較 by 陳建仁副總統
治療經驗
新型冠狀病毒 武漢肺炎 COVID-19 治療經驗分享
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯喹
小心沉默的肺炎!日本自衛隊中央病院新冠治療經驗
日本疫情
東京面臨感染爆發重大局面 東京封城?首都封鎖?
日本新型冠狀病毒疫情懶人包 日本還能不能去?現階段可以去日本旅遊嗎?
日本武漢肺炎 新冠病毒 COVID-19流行地圖
日本旅遊回來要被隔離14天嗎?可退費嗎?何謂旅遊疫情建議等級 流行地區分級?
台灣日本南韓新冠PCR檢驗量及陽性率比較 大阪 vs 北海道
鑽石公主號郵輪新型冠狀病毒疫情懶人包 由一個香港案例傳染給至少135人的海上悲劇




東京8805間旅館比價 京都7134間旅館比價
日本訂房請參考住宿懶人包,林氏璧推薦的二十四家東京旅館,26家大阪旅館,十三家京都旅館。
訂房網站推薦Relux,e路東瀛,Booking.com,Agoda。也可先用 旅館查價網站來看是否有便宜。訂行程網站推薦KKday,KLOOK客路。
到日本上網分享器和SIM卡的問題請看過這兩篇:2023日本上網卡 SIM卡懶人包,日本行動上網分享器懶人包。
各種毒友優惠及現在的活動請見:全日本篇,東京優惠,關西京阪神優惠,九州優惠,北海道優惠,沖繩優惠。
歡迎加入林氏璧的日本自助旅遊中毒者臉書粉絲專頁,或是小狸的日本購物血拼中毒者臉書粉絲專頁,接收最新日本旅遊訊息。近期有什麼活動會在粉絲專頁置頂,LINE官方帳號:@linshibi 則會直接發送最新的優惠訊息。
RSS訂閱/ 以Email訂閱 本站,東京訊息不漏接。
本站導覽 新手第一次到本站的導覽,比較容易找到資料喔。
重要公告 即日起本部落格(包括臉書頁面/私訊/e-mail)在非公開頁面不回答日本旅遊的常見問題,請各位見諒。請一律在日本自助旅遊中毒者臉書社團中問題讓大家集思廣益。
日本/東京自助旅遊的常見問題FAQ 新手請優先閱讀。



