橫斷性脊髓炎是什麼?阿斯特捷利康和牛津大學合作的腺病毒新冠疫苗懶人包



英國阿斯特捷利康藥廠(AstraZeneca)和牛津大學合作的腺病毒疫苗「AZD1122」,第三期臨床試驗於6月15日開始收案,預計在巴西收案兩千人。
這是以一個黑猩猩的腺病毒(ChAdOx1)為載體的疫苗,在動物實驗上證明疫苗可以提供保護力。第一期/第二期合併臨床試驗發現此疫苗可產生抗體,且安全沒什麼副作用。目前在英國和印度進行第二期/第三期合併臨床試驗,也在巴西還有南非進行第三期臨床試驗。
五月時,美國提供12億美金的投資,訂下3億劑疫苗。八月時,歐盟和阿斯特捷利康簽訂4億劑疫苗的合約。 此外的訂單:日本1.2億劑,英國1億劑,巴西1億劑,COVAX 13億劑。若一切順利,預計可提供全世界每年20億劑的疫苗。這支疫苗是COVAX的待選疫苗之一,台灣有機會可以經由COVAX的途徑買到。
在價格方面牛津疫苗是訂價最便宜的疫苗,售價大約只有3英鎊,和一杯咖啡差不多,而輝瑞疫苗價格約15英鎊,莫德納疫苗約25英鎊。牛津疫苗的生產合作伙伴阿斯利康製藥公司表示,不會靠賣疫苗賺錢,生產出的疫苗提供任何國家使用,因此價錢最低。
且和輝瑞及莫德納這樣的RNA疫苗相比,牛津疫苗和其他大多數的疾病疫苗相同,不需要特別的冷鍊。牛津疫苗可以在一般冰箱的溫度下(攝氏2至8度之間)儲存至少半年,因此能夠輕鬆運送到世界各個角落。若考慮冷鍊運送和保存成本,RNA疫苗的成本就更貴了。
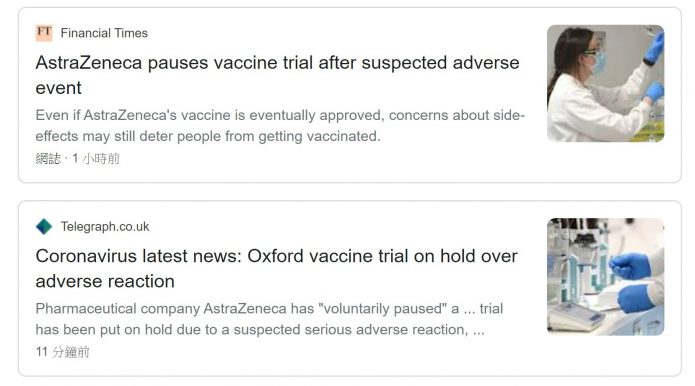
2020.9.9:阿斯特捷利康宣布,其新冠冠苗第三期臨床試驗因安全顧慮而暫時中止
2020.9.9:紐約時報報導牛津疫苗的受試者發生了橫斷性脊髓炎
2020.9.10:STAT網站報導:在新冠疫苗組英國女性產生神經學方面的症狀
2020.9.10: 黃立民/李秉穎老師的意見
2020.9.14:牛津疫苗臨床試驗在英國重啟
2020.9.19:巴西南非皆重啟牛津疫苗臨床試驗 CNN披露安全性報告 佛奇表示:在美國重啟只是時間問題
2020.10.23:牛津疫苗臨床試驗在美國重啟
2020.11.19:牛津疫苗第二期臨床試驗發表在刺胳針期刊 年長者也有極好的抗體和T細胞反應
2020.11.23:牛津疫苗有七成保護力,不同劑量最高可達九成
2020.12.8:牛津疫苗第三期部分臨床試驗結果發表在刺胳針期刊 低劑量組讓人更疑惑
2020.12.30:英國通過牛津疫苗緊急使用授權 但我的問題更多了….
我在9月14日直播講了這個題目,請參考!
時間軸:
1:34 全世界好像正在等疫苗出現一哄而散….
4:02 到底怎麼樣做才叫做”確保了疫苗的安全性”?
5:02 美國各大疫苗廠發聯合聲明,強調將以疫苗安全性為第一優先
9:27 牛津腺病毒疫苗是用黑猩猩的腺病毒(ChAdOx1)為載體,若有問題,不代表其他腺病毒疫苗一定會有問題。
11:32 阿斯特捷利康:受試者發生了不能解釋的疾病,暫停試驗
13:03 嚴重不良事件(SAE)還是嚴重藥物不良反應(SAR)?
18:41 紐約時報報導牛津疫苗的受試者疑似發生了橫斷性脊髓炎(Transverse myelitis)
22:12 什麼是橫斷性脊髓炎?
25:28 病因:有六成是找不到原因的,其他四成則有許多原因,包括自體免疫,感染,打疫苗後等等
27:23 張上淳老師的回應
04b的解讀1:
28:33 此例到底是實驗組還是對照組?
28:55 許多疫苗最怕觀察到的副作用就是產生類似這樣自體免疫攻擊神經系統的稀有疾病
31:40 考慮該不該繼續進行臨床試驗的種種考量
33:22 橫斷性脊髓炎本身的診斷複雜,需要和許多其他的疾病作鑑別診斷
34:12 STAT網站報導:CEO在投資人會議上揭露確有英國女性產生神經學方面的症狀,診斷還沒最後確認,已改善到可出院。此人應該是在新冠疫苗組
38:44 七月時也有過一次暫停,那次有一位受試者發生了多發性硬化症(multiple sclerosis),後來判定和新冠疫苗無關
40:56 黃立民老師的回應
42:50 李秉穎老師的回應
45:37 牛津大學宣布:臨床試驗會在英國重啟。目前全世界已收案一萬八千人
47:22 因為受試者資料保密,無法公布此受試者得到疾病的資訊
48:16 阿斯特捷利康:安全委員會的建議是在英國繼續進行此臨床試驗是安全的
52:50 紐約時報:疫苗廠對疫苗安全的細節噤聲
04b的解讀2:
53:54 到底是怎麼樣能在六天之內能決定這個疫苗臨床試驗繼續做下去是安全的?
58:06 用資料保密的理由更是荒謬,這肯定紙包不住火的
1:00:12 此事件讓某些人對這個疫苗的信心有重大打擊
1:02:10 04b回答問題時間
1:02:27 今年冬天的流感疫苗請打好打滿
1:03:25 橫斷性脊髓炎症狀可以有輕有重,治療方式是用高劑量類固醇
1:04:33 試想一下,如果這件事發生在台灣…..
1:06:18 為何很多疫苗臨床試驗在巴西做?
1:09:01 做決策的過程 安全性資訊應該要更透明
1:11:45 台灣以爭取「緊急授權製造」(代工)轉向「預購」
1:14:23 COVAX我們會分到什麼疫苗?


東京必備優惠券一整包 關西京阪神必備優惠券一整包
2020.12.30更新:英國通過牛津疫苗緊急使用授權 但我的問題更多了….
1.就在台灣指揮中心宣布我們購買一千萬劑的疫苗就是牛津/AZ疫苗的同一天,英國藥品及保健產品管理局(Medicines and Healthcare products Regulatory Agency,MHRA)率先批准了牛津疫苗的緊急授權使用,但他們審查的資料和報告並沒有第一時間公開。
2.MHRA首席執行長芮恩(June Raine)在唐寧街進行疫苗簡報表示,批准的是全劑量打兩劑,兩劑可以間隔4~12週施打。記者會中專家表示在一群受試者兩劑間隔約12週施打,這樣的保護效力可以升高到80%,因此做出此建議。只打一劑的話可達約70%的保護力。
3.MHRA沒建議半劑量,因為他們認為之前半劑量組九成有效性的結論主要是因為拉長施打間隔所致。
4.英國的新冠單日確診數29日才首度突破單日4萬人,今天又突破5萬人,新增5萬3135人確診,疫情十分嚴峻。衛生大臣韓考克(Matt Hancock)表示,英國當局訂購1億支牛津大學疫苗,每人施打2劑,足夠讓5000萬人施打;加上先前的輝瑞/BNT疫苗,將足以供應全英國人口。牛津疫苗不像輝瑞疫苗必須保存在攝氏零下70度環境,只要冷藏即可,較容易儲藏與配送。
5.英國首相強生說牛津疫苗研發是英國科學界的勝利,並表示「我們將盡快讓所有人獲得接種。」由於英國已經有兩款疫苗獲得許可,雙管齊下希望能在1週內讓200萬人接種。自從90歲老婦人基南(Margaret Keenan)在12月8日率先接種疫苗之後,至今英國已有60萬人接種。
6.MHRA也同時更改了對輝瑞疫苗的施打建議,從原本在21天時施打第二劑,改為至少離21天,且可以和牛津疫苗一樣延後至4~12週再打第二劑。
04b解讀:
1.這次MHRA和Lancet已經出版的臨床試驗結果數字顯然不一樣。他們拿到的資料應該是最新的,英國一直在滾動式審查其資料,所以可以很快的批准。但他們沒公布詳細的評估報告,只說之後會公布。
2.對於全世界投予期待迫切希望能解決問題的新冠疫苗來說,大眾對他的信任應該是重中之重。美國FDA這次批准兩支RNA疫苗是完全儘量透明公開,資料先上網,直播八小時的開會過程,最後還是記名投票的。因為美國知道這兩個疫苗全部科學家都會以放大鏡來檢視,因此採取了盡量透明的策略。
3.我不會擔心牛津疫苗沒效,但最大的問題是,直到現在,實在搞不懂劑量應該怎麼給是最好的…半劑量全劑量,4~12週,都已經緊急授權了還神神祕祕不公布資料?這陣子以來牛津疫苗上發生的每件事都會讓人質疑不夠透明,從橫斷性脊髓炎,新聞稿公布,到現在連英國MHRA自己都神神秘秘的。我只能說美英兩國真的是完全不同風格…
4.兩劑可以間隔4~12週施打,會有這樣的時間差是因為牛津臨床試驗原本想只打1劑,後來才決定要打第2劑,這讓受試者的施打時間就是分布在4~12週之間。但另外一個考慮是如果這樣建議,短期間疫苗還短缺的時候就可以讓更多人施打第1劑獲得相當的保護效果,不論個人的保護力,這學理上可能對整體疫情控制是有好處的。
但在記者會上所回答的 #施打間隔相隔12週可以達到80%保護力,#只打1劑有70%的保護力,如果真的是這樣很好,但請給我看完整的臨床試驗數據。之前已經公布的Lancet的論文中標準劑量僅有62.1%的保護力,也曾以施打間隔小於6週或大於6週為切點來分析,並無看出顯著差異。我會懷疑至今能累積多少案例支持這樣的結論。
5.至於要讓輝瑞疫苗也建議可以到相隔12週施打,更是完全沒有科學基礎的建議。輝瑞臨床試驗就是相隔21天施打,這可能讓這個施打疫苗的個人無法獲得完整的保護力。且聲稱輝瑞1劑疫苗追蹤到21天就有多少保護力是較無意義的,因為21天後就打了2劑疫苗,打1劑疫苗後只觀察21天有一定的保護力,但沒有人知道如果真的只打1劑的話保護力是多少。因為臨床試驗中根本沒這個組別呀。
6.變種病毒B117在英國部份地區已經是主要流行株,而這繼續進行的臨床試驗中顯然沒有觀察到現有牛津疫苗失效,我想這點至少是比較令人安心的。
7.美國和歐盟的法規單位都表示,牛津疫苗大概需要到2021年2月左右才可能會被緊急授權。美國會希望等待更多在美國執行的AZ臨床試驗結果出來。歐盟的話,到12月底還沒有收到此疫苗的緊急授權申請。
英文好的朋友建議直接看記者會,後面記者問的問題很讚。英國記者非常會問問題!
新聞稿在此
Second COVID-19 vaccine authorised by medicines regulator: Oxford University/AstraZeneca vaccine meets regulator’s strict standards of safety, efficacy and quality.
紐約時報:U.K. Authorizes Covid-19 Vaccine From Oxford and AstraZeneca
路透社:No half measures and mind the gap: UK nod for AstraZeneca vaccine raises more questions
2021.1.2更新:英國拉長輝瑞2劑疫苗接種間隔期 官方醫界掀論戰 佛奇也不贊成
1.英國在通過牛津疫苗第二劑可在4~12週後施打,並說先一步通過的輝瑞/BNT疫苗第2劑也可從原本的3週延後到12週施打,引來醫界和專家異議。英國官員強調,這能讓盡可能多的人接種第一劑疫苗,此決定將盡可能多保護感染風險較高的民眾。
2.輝瑞藥廠於12月31日聲明:「輝瑞和BioNTech 的新冠疫苗第3期臨床試驗,是設計來評估間隔21天接種2劑疫苗後的安全性和有效性。沒有資料證明,接種第一劑疫苗後,過了21天,防護力仍然持續。」
3.代表醫師的英國醫學會(BMA)批評,這將讓目前正等候接種第2劑疫苗的極脆弱患者延後預約接種時間。
4.英國醫學會全科醫師委員會(General Practitioners Committee)主席沃特里(Richard Vautrey)指出:「極高齡患者群體若染上COVID-19,死亡風險最高,這就是為什麼全科醫師如此擔心他們。現在要數以萬計風險最高的患者試著重新安排接種時間,顯然相當不公平。」
5.英國醫師協會(Doctors’ Association UK)今天也對新的疫苗策略提出「嚴正關切」,警告此舉會破壞國民健保署(NHS)的患者同意程序,「也完全沒有遵循科學」。
6.英格蘭、蘇格蘭、威爾斯和北愛爾蘭首席醫療官員昨天在寫給醫護專業人員的公開信中,聯合替新的疫苗策略辯護。他們說,這項決定是基於「風險和效益的平衡」。「短期來說,第2劑疫苗帶來的額外增加效力可能不是很大;對臨床疾病的初期保護力絕大多數是在第一劑疫苗接種後開始。」
7.佛奇在CNN專訪中表示:從臨床試驗中我們知道莫德納第二劑是間隔28天施打,輝瑞是間隔21天施打。你可以爭論說拉長施打時間會不會有效,但我不建議如此做。
04b解讀:
1.第2劑疫苗帶來的額外增加效力可能不是很大—>這句話是猜測,是沒有科學證據的。輝瑞疫苗從第1/第2期開始就是打兩劑,並沒有只打1劑的組別可以觀察。只以科學觀點來看,英國這舉動非常瘋狂。輝瑞臨床試驗就是相隔21天施打,延長施打時間有可能讓這個施打疫苗的個人無法獲得完整的保護力。
2.當然我明白這是基於公衛的決定,英國目前疫情嚴峻且疫苗供應有限,希望能延遲第2劑讓更多人更快施打到疫苗而有一定的保護力。在12週之後,希望疫苗產能已經可以追上來,再讓大家補接種。這個決定有點大膽。
3.另外要提醒的是牛津是腺病毒疫苗,和輝瑞莫德納這種RNA疫苗是否打第2劑,還有打第2劑間隔要多少,可能答案是不一樣的。因為腺病毒疫苗一般來說有可能第2劑反而效果不好,抗體無法進一步提升,搞不好拉長注射間隔會較好。但其它疫苗通常第2劑會有加強效果(booster effect),可以延長保護的時間。
Dr Anthony Fauci says US will not delay second doses of Covid vaccine
中央社報導:英國拉長輝瑞2劑疫苗接種間隔期 官方醫界掀論戰

2020.12.8:牛津疫苗第三期部分臨床試驗結果發表在刺胳針期刊 低劑量組讓人更疑惑
最晚公開新聞稿的牛津疫苗,卻最早將第三期臨床試驗發表在刺胳針期刊(Lancet),離公布新聞稿僅有15天。這天也是英國開打新冠疫苗的日子,不過開打的是輝瑞/BNT疫苗,並不是英國自己的牛津/AZ疫苗。快來仔細看看!
目前公布的資料出自正在進行中的四個臨床試驗的內部分析,有效性是從英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003)共11636人來分析,安全性則是從英國,巴西和南非執行的四個臨床試驗超過兩萬人的資料來分析。整個第三期全球會收案到六萬人,目前只是部份的資料。
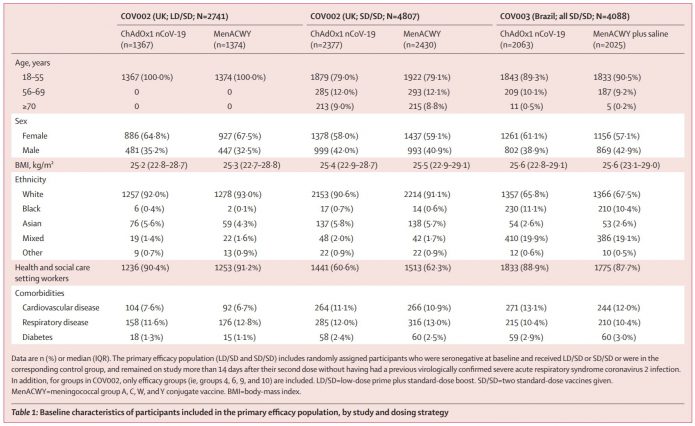
受試者是大於18歲的成人,1比1的收案為疫苗組或是對照組。疫苗組主要是打兩劑的標準劑量組(SD/SD cohort),英國COV002有4807人,巴西COV003有4088人。在英國則有多出一個低劑量組(LD/SD cohort),2741人。
低劑量組(第一劑的劑量僅有半量,之前解釋過這是不小心多出來的,劑量誤差是承包商所致,發現問題後督導單位立即通報並決定繼續試驗,改計劃書分為不同劑量組進行。但這2741人僅在18~55歲收案,且是密集在2020年5月31日到6月10日中收案的。後來發現問題,計畫書在6月5日改變,之後就是打全劑量了。56~69歲是8月8日開始收案,≥70歲是8月13日開始收案。
另外還有一個問題,18-55歲這組原本是設計僅要給一個劑量。但因為後來發現給兩劑的免疫生成會比較好,所以在7月20日更改計畫書要追加一劑,變成施打兩劑。8月3日開始追加劑量,因此在年輕人組兩劑間的間格時間可能長達兩個月以上,會遠大於年長組的平均隔28天施打(年長組從開始就計劃要打兩劑)。
主要有效性指標是看注射完第二劑14天免疫力產生後,追蹤有症狀的新冠確診案例。資料追蹤至2020年11月4日。
結果:
1.從2020年4月23日到11月4日為止,共有23848位受試者參加,其中11636人包括在這次的有效性分析(英國7548人,巴西4088人)。
2.目前總共131例新冠確診,疫苗組中有30個,安慰劑組中有101個確診。在疫苗組中即使確診,也沒有新冠重症或須要住院的。注射完第一劑21天之後,共有10個因為新冠確診需要住院的案例,全部發生在對照組。其中有兩例是新冠重症,一例死亡。
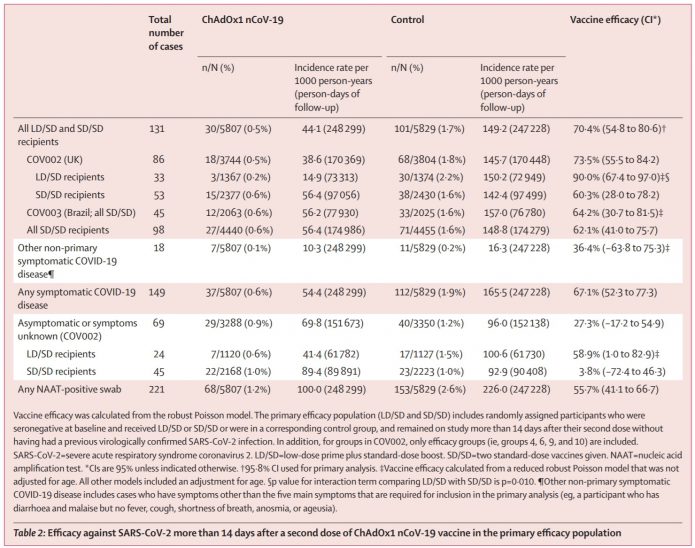
3.標準劑量組:4440人中有27人(0.6%)得新冠,相對於對照組4455人中有71人(1.6%)得新冠,保護力僅有62.1%(95% CI 41·0–75·7)。
低劑量組:1367人中有3人(0.2%)得新冠,相對於對照組1374人中有30人(2.2%)得新冠,保護力可達90%(95% CI 67·4–97·0)。
兩者合在一起的資料(共11636人),保護力是70.4%(95% CI 54·8–80·6)。
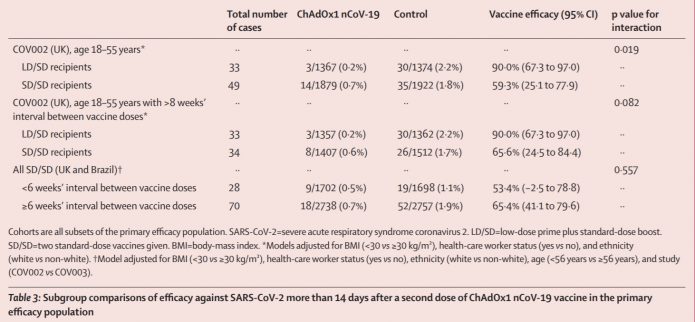
4.這是若只看英國18~55歲者,英國兩劑是不是大於8週,還有英國巴西兩劑小於6週或是大於6週來分。由於低劑量組只有收18~55歲,且絕大多數都是兩劑間隔大於8週,沒有年長者半劑量的資料。我們大概只能說,年長者劑量間隔拉長好像保護力有點變好,但我們無法確認18~55歲到底是因為半劑量讓效果變好,還是因為間隔拉長,還是兩者都有關。
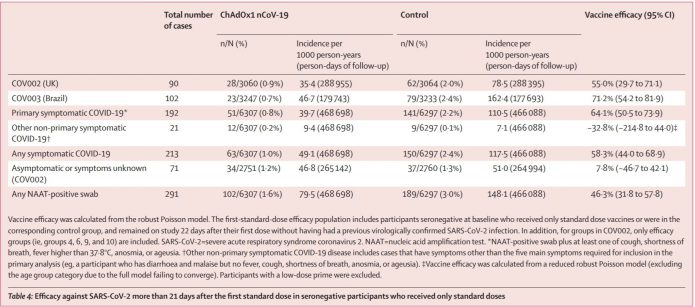
5.有趣的是,只看PCR陽性的話,也有抓出一些無症狀感染者。
6.安全性方面,目前累積74341 人-月的追蹤 (中位數3.4個月)。在168位受試者共發生了175件嚴重不良事件,其中84件在疫苗組,91件在對照組。有三件可能和疫苗相關,有一件是在新冠疫苗組,另外有一例還沒解盲。
牛津臨床試驗追蹤兩萬多人中共發生了五死。一個是對照組中產生的新冠重症。另外四死是車禍,外傷,他殺,還有黴菌的肺炎,一例在疫苗組三例在對照組。
一例是最早傳出的脊髓炎,發生在注射疫苗後14日。判定可能和疫苗有關。
另外還有兩例脊髓炎,一例是疫苗組一例是對照組。疫苗組這新聞中也有報導過,就是一開始認為和疫苗相關,但後來調查應該是病人本來就有未診斷的multiple sclerosis。因此目前判定和疫苗不太可能相關。

2020.11.23:牛津疫苗有七成保護力,不同劑量最高可達九成
沒想到牛津/AstraZeneca合作的疫苗第三期臨床試驗的初步結果也這麼快就出來了。平均保護力70%,但如果更改疫苗劑量的話保護力可以提高到90%。到底怎麼回事?來整理一下!
1.目前公布的資料出自在英國的第二期/第三期臨床試驗(COV002),還有巴西的第三期臨床試驗(COV003),共收案兩萬三千人,其中約半數的參與者在英國,其餘在巴西。整個第三期全球會收案到六萬人,目前只是部份的資料。
2.此臨床試驗有兩種不同打法。都是打兩劑,但第一劑的劑量不同。
2741人:第一劑打半量的效果反而好,保護力可達90%。
8895人:第一劑打全量的,保護力僅有62%。
兩者合在一起的資料(共11636人),保護力是70%。
目前總共131例新冠確診,疫苗組中有30個,安慰劑組中有101個確診。在疫苗組中即使確診,也沒有新冠重症或須要住院的。新聞稿並沒有公布安慰劑組中有幾例重症或住院。
3.沒有確認和疫苗有關的嚴重不良反應。(我說呀,那個橫斷性脊隨炎到哪裡去了….)
4.BBC報導指出,輝瑞和莫德納研發的疫苗都有95%的保護力,而牛津研發的疫苗只有70%的保護力,可能有人對此會感到失望。但是,任何能取得50%以上保護力的疫苗都算是成功,70%也比一般的季節性流感疫苗要更好。
5.新聞稿上沒有,但新聞有報導他們還觀察到在疫苗組中無症狀感染者也減少了。這可能代表疫苗也可以減少經由無症狀感染者人傳人的機會。但目前沒有看到詳細的數字。
佛奇的意見:
1.為何打一半量的效果反而好?這應該很多人會有意見。但佛奇表示,這可能反而消除了對使用兩劑病毒載體疫苗的擔憂。如同李秉穎老師常說,使用腺病毒當載體把S蛋白帶進人體,若人體對此病毒載體有抗體,疫苗效果可能會變差。
佛奇猜測,一開始較低劑量已經足夠引發身體產生T細胞免疫,但沒有引發產生對腺病毒的抗體在打第二劑時反過來壓制第二劑應有的加成(booster)效果。
2.如果最後累積更多資訊,結論是保護力真的只有70%,那我們面臨一個難題。當你已經有兩個保護力95%的疫苗,那70%的這個怎麼辦?要在哪些人身上注射呢?
3.佛奇也提醒,在還沒有看到全部資料之前,不要輕易下結論。
04b解讀:
1.一定會寫上的警語:要提醒這僅是新聞稿,詳細資料還沒正式發表。追蹤時間還不夠長,時間更久也許疫苗組還是可能染病。且還有很多問題待解,到底可以徹底預防感染嗎?在不同族群,特別是年長者保護力如何?保護力可維持多久?但我想初步有這樣的結果是讓人樂觀的。
2.不過牛津的這個新聞稿,必須說實在不夠透明呀。公布的資訊少的可憐。我也覺得很奇怪,原本有風聲傳出12月底前第三期臨床試驗初步結果才會出來,但現在早了一個月,且僅有其中11636人的資料,不像另外兩個美國的臨床試驗都是收了三萬,四萬人的資料。有點想提早公布,但資料還準備不全的感覺。
3.為何打一半量的效果反而好?有人說,可能和對腺病毒載體的抗體有關,或是從低量到高量的暴露讓抗體產生效果較佳。這裡目前我沒有太好的答案。打半量的組別僅有近三千人,可能資訊還不夠多到可以下確切結論。不管如何,打一半量的效果好可能算是好事,可以讓更多人施打。
4.也有美國專家批評這次牛津疫苗臨床試驗整個透明度不夠高。比方說,莫德納和輝瑞都是第一時間就把臨床試驗計畫書公布讓全世界都可以看,很早就訂出何時要做內部分析,牛津就沒有。牛津/AZ這次處理真的不夠透明,從橫斷性脊髓炎不良反應事件的處理,到這次新聞稿的發布,都看的出來。你們知道嗎?美國的牛津疫苗四萬人臨床試驗8月18日開始收案,根本沒有半劑量的組。英國佬到底在搞什麼….哈哈。STAT網站報導,AZ預計要在美國的臨床試驗也增加半劑量的組別。不過這樣就意味,整個臨床試驗出來的時間又要往後延遲了。
老美就說了:
我很高興這不是第一個我們需要解讀的疫苗,因為這結果對於專家和一般人來說,都是同樣的令人困惑。
I’m glad this is not the first vaccine to read out, because it is awfully confusing for experts and non-experts alike.
5.牛津疫苗有在COVAX的第一批九支候選疫苗之中,台灣有機會可以經由COVAX的途徑買到。五月時,美國提供12億美金的投資,訂下3億劑疫苗。八月時,歐盟和阿斯特捷利康簽訂4億劑疫苗的合約。 此外的訂單:日本1.2億劑,英國1億劑,巴西1億劑,COVAX 13億劑。若一切順利,預計可提供全世界每年20億劑的疫苗。
6.在價格方面牛津疫苗是訂價最便宜的疫苗,售價大約只有3英鎊,和一杯咖啡差不多,而輝瑞疫苗價格約15英鎊,莫德納疫苗約25英鎊。牛津疫苗的生產合作伙伴阿斯利康製藥公司表示,不會靠賣疫苗賺錢,生產出的疫苗提供任何國家使用,因此價錢最低。
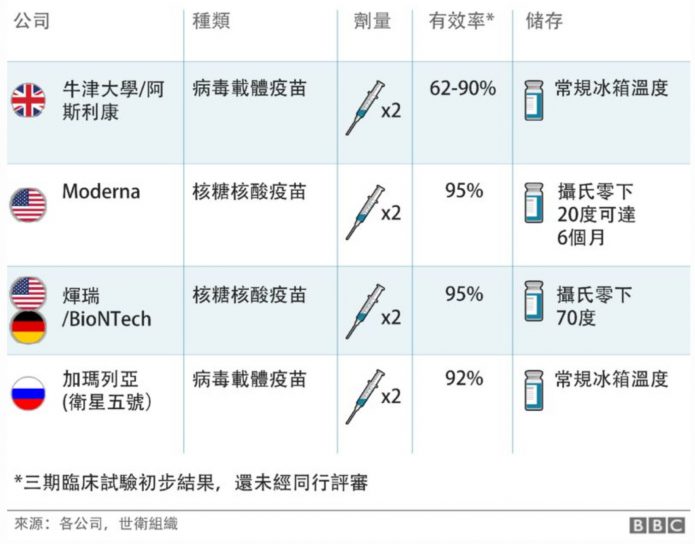
7.且和輝瑞及莫德納這樣的RNA疫苗相比,牛津疫苗和其他大多數的疾病疫苗相同,不需要特別的冷鍊。牛津疫苗可以在一般冰箱的溫度下(攝氏2至8度之間)儲存至少半年,因此能夠輕鬆運送到世界各個角落。若考慮冷鍊運送和保存成本,RNA疫苗的成本就更貴了。
8.不論如何,以全世界的觀點,牛津疫苗是比前面兩個RNA疫苗更有機會可以大量施打,解決問題的。希望接下來會有更多好消息。
新聞稿:AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19
BBC:Covid-19: Oxford University vaccine is highly effective
新冠疫苗:牛津疫苗研發成功 三種疫苗各有優勢
紐約時報:AstraZeneca’s Coronavirus Vaccine, Easy and Cheap to Produce, Appears Effective
STATNEWS:AstraZeneca Covid-19 vaccine is 70% effective on average, early data show

2020.11.19:牛津疫苗第二期臨床試驗發表在刺胳針期刊 年長者也有極好的抗體和T細胞反應
首先寫在最前面,許多媒體把牛津疫苗99%產生抗體的這個數字和輝瑞的95%還有莫德納的94.5%有效性(efficacy)相比,這是不倫不類的。99%這是immunogenecity(免疫生成性)的資料,是否可以真正預防感染,這要做完第三期才知道。這兩種數字不應該拿來比較。
1.這次正式發表在刺胳針期刊(Lancet)的內容是牛津疫苗第二期/第三期臨床試驗COV002其中第二期的初步結果,在英國的20間醫院收案。第二期的部分是最前面收的560人的結果,這些人還在持續追蹤中,會追蹤到一年。看他們會不會真的感染。整個第三期在英國總共收案12390人,
2.第二期是隨機單盲有對照組的收案,給予一劑或兩劑,低劑量或高劑量。從5月30日到8月8日之間總共收案560人,其中18~55歲160人(100人疫苗組,60人對照組),56~69歲160人(120人疫苗組,40人對照組),70歲以上240人(200人疫苗組,40人對照組),要看各年齡的免疫生成性還有安全性。
3.免疫生成性分為抗體免疫和細胞免疫,會用ELISA測抗體,也會用MNA80的方式測中和抗體。細胞免疫則是用 ex-vivo IFN-γ enzyme-linked immunospot assay。(這兒我就不多做解釋了…)
4.在施打兩劑之後,99%的受試者出現中和抗體。年長者也有極好的中和抗體和T細胞反應,幾乎和年輕人差不多。
5.安全性方面,常見的副作用包括了注射處疼痛,覺得發燒,頭痛,肌肉痠痛。年長組的副作用比例反而比年輕組為低。局部副作用比例:18~55歲(88%),56~69歲(73%),70歲以上(61%)。全身性反應副作用比例:18~55歲(86%),56~69歲(77%),70歲以上(65%)。
6.截至10月26日,有報告13例嚴重不良事件。研判都和疫苗無關。
04b解讀:
1.牛津第二期臨床試驗最重要的發現就是在最需要疫苗的年長者族群,不但副作用比例比年輕人低,且免疫生成性也非常好。這一點非常令人鼓舞,因為在之前的幾個第二期結果中,通常在年長者的免疫生成性都會比較差一些。
2.但實際上是否真的有保護力?就要看進行中的第三期臨床試驗的結果了。牛津疫苗的結果預期會在12月底前發表。
3.張上淳老師在11月18日記者會中有提到,疫苗一期二期臨床試驗是看免疫生成性,看產生多高的抗體,特別是多高力價的中和抗體。越高的中和抗體應該是越有可能預防感染。但這是全新的病毒,沒有足夠資料時無法認定抗體力價多高是確實有保護力的。但隨著國外第三期陸續有結果,就可以看力價高到什麼程度以後幾乎沒有人感染,界定出可預防感染的抗體力價。往後疫苗發展可以參考之前的數據,看能否達到這麼高的力價,進而決定一支疫苗夠不夠好,未必要去高風險國家做臨床試驗。以流感疫苗為例,每年季節的流感疫苗都是看接種後產生多少力價,就可判定此疫苗夠不夠好。
我上週在直播也有提到這一點。如果台灣的新冠疫苗要在2021年6月左右做完第二期就緊急授權開始施打,有效性方面,那時可能國際已經會有抗體力價的規定訂出來,這點比較沒問題。這樣就剩下安全性的問題比較擔心了,因為有些比較少見的副作用是要上萬人才能偵測出來的。不過我相信那時國際的法規會有所因應,因為全世界有超過100個新冠疫苗正在研發,每家都去花大錢做第三期臨床試驗有實際上的困難。特別是如果接下來幾個疫苗上市了,確認有有效的疫苗,照原本這樣執行對照組的第三期臨床試驗也可能會有醫學倫理的問題!
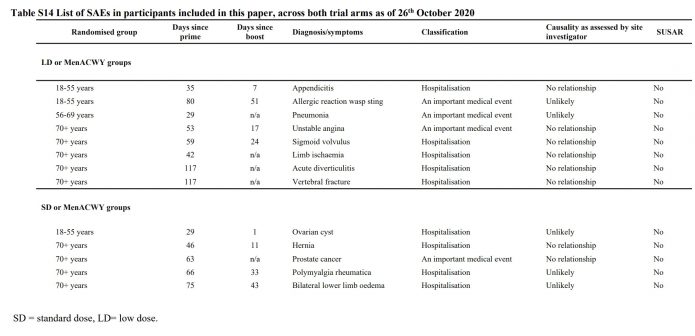
4,之前提過的橫斷性脊髓炎那個案例,還有8月也有一位神經學症狀的案例,應該是在第三期的受試者,還沒在這次報告之中。上表是在附錄中的13例嚴重不良事件,包括卵巢囊腫,盲腸炎,骨折,攝護腺癌導致住院等,研判都和疫苗無關。
2020.10.23:牛津疫苗臨床試驗在美國重啟
歷經一個半月,FDA終於宣布,牛津疫苗臨床試驗可以在美國重啟。至此牛津疫苗在全球的臨床試驗都重新啟動,包括了美國,英國,南非,巴西和日本。FDA檢視了所有安全資訊,判斷繼續執行臨床試驗是安全的。
紐約時報報導,FDA的結論是沒有證據此疫苗直接造成了此兩案例神經學的副作用。但還是沒有進一步詳細的說明。根據兩位專家的內線消息,FDA無法完全排除和疫苗的關聯性。他們建議阿斯特捷利康要和受試者提醒注意可能發生的神經學相關症狀。

2020.9.19:巴西南非皆重啟牛津疫苗臨床試驗 CNN披露安全性報告
巴西還有南非已經分別在14日還有17日重啟牛津疫苗的臨床試驗,目前只剩美國了。9月17日CNN報導,聲稱取得了一份藥廠的內部安全性報告。此報告發出日期是9月10日,描述此發生神經學症狀的受試者為37歲女性,是在第二劑疫苗之後的14天發生。報告中是以”confirmed transverse myelitis”,”確認的橫斷性脊髓炎”來描述之。

她的第一劑是六月初,第二劑是在八月底。9月2日她在跑步時差點跌倒,但並沒有任何外傷。隔天開始,她發生走路困難,手臂痛還有無力,軀幹痛且有感覺減少,頭痛等等症狀,於是在9月5日住院。
在報告中提到有照會神經專科醫師,其建議是這樣的症狀和橫斷性脊髓炎是吻合的。此案例症狀已經快速改善,力氣還有手的靈活度都變好了。

這段文字是9月11日更新的牛津疫苗給受試者看的說明,關於可能出現的副作用:
在目前的臨床試驗中我們曾經因為受試者有無法解釋的神經學症狀,包括感覺異常或肢體無力而暫時中止臨床試驗做安全性的調查。
在獨立調查之後,這些症狀不是被認為不太可能和疫苗相關,就是認為沒有足夠證據顯示和疫苗相關或不相關。安全委員會都建議應該繼續臨床試驗。我們會繼續密切觀察所有受試者可能產生的副作用。
佛奇則和CNN表示,牛津疫苗在美國重啟只是時間問題。他認為目前這個僅是一次性的事件,不太可能只因為一個單一事件就停掉整個臨床試驗。但從現在開始當然要特別小心看其他受試者會不會發生類似的症狀。如果再發生了,那就和現在是完全不同的狀況了。
紐約時報在19日的報導也有提到一些美國專家對此次事件的批評。詳情大家自己看吧。
AstraZeneca, Under Fire for Vaccine Safety, Releases Trial Blueprints
其中有訪問一位休士頓貝勒醫學院的病毒學家Peter Jay Hotez,他受訪表示:英國法規單位公布的聲明無法提供重啟臨床試驗的解釋。
“Tell us why you came to that decision,” he said.
告訴我們為何你們會做下這個決定。
這句話就是我14日直播說的,對吧。
2020.9.9 9AM更新:
阿斯特捷利康(AstraZeneca)宣布,其新冠冠苗第三期臨床試驗因安全顧慮而暫時中止。該公司發出聲明表示:「這是常規行動,只要一項試驗有潛在未能解釋的疾病,進行調查時就會這樣做,以確保維持試驗的完整性。在大型試驗中,疾病偶然發生,但必須對其進行獨立審查以仔細檢核。」
阿斯特捷利康說,正試圖加速審核以便「最小化對試驗時程表的任何潛在影響」。
根據新聞網站STAT News,一位知情人士說,在英國一位試驗參與者發生嚴重不良反應後,研究人員被告知「出於充分謹慎」的考慮,試驗暫時中止。

04b解讀:
A.昨晚直播講的事情馬上發生了。應該是受試者中發生了某種症狀,被界定為嚴重不良事件(SAE,serious adverse event)。目前不知是怎樣的狀況,沒有公佈。
B.嚴重不良事件的定義:造成受試者有以下狀況之一者。
1.死亡。
2.危及生命。
3.造成永久性殘疾。
4.胎嬰兒先天性畸形。
5.導致病人住院或延長病人住院時間。
6.其他可能導致永久性傷害需做處置者。
C.嚴重不良事件不一定和疫苗有因果關係,如果判斷有合理之因果關係者,那叫做嚴重藥物不良反應(SAR,serious adverse reaction)。Event和reaction不一樣,event是事件,還不一定是實驗藥物引起。但如果說reaction,就是比較確認和藥物的因果關係了。
目前歐美新聞媒體寫的很亂,我不確定應該是哪一個。但我猜目前應該是嚴重不良事件(SAE),尚未釐清和疫苗的關係。因為這是個雙盲的臨床試驗,不管受試者,參與醫師和廠商應該都不知道受試者是實驗組還是對照組。
D.現在要做的事情是昨天說的那個獨立專家組成監測安全的委員會(DSMB)要仔細審查判斷,要不要對這個案例解盲,是否是疫苗引起的,如果是疫苗造成,有沒有別的案例發生類似的副作用,是否嚴重到要不要因為這件事停止整個臨床試驗。
這樣的事情可大可小,先不用太擔心。靜待進一步的消息。
阿斯特捷利康宣布暫停疫苗試驗 股價聞聲下跌6%
STAT網站:AstraZeneca Covid-19 vaccine study put on hold due to suspected adverse reaction in participant in the U.K.
2020.9.9 8PM更新:
#如果真的是牛津新冠疫苗可能造成橫斷性脊髓炎 這個疫苗真的遇上大麻煩了…
今天張P在記者會上回答牛津疫苗疑似產生了脊髓炎的副作用。來解釋一下。
橫斷性脊髓炎(Transverse myelitis)是一種非常稀有的疾病,大概每百萬人僅有4.6人。顧名思義就是脊髓(spinal cord)發炎、且是水平的橫跨脊髓,從而造成神經學症狀。
症狀:橫斷性脊髓炎會導致發生部位及以下的感覺神經、運動神經和自主神經系統都出問題,會有怎樣的症狀端看影響到的是哪一截的脊髓。常見的症狀包括肌肉無力,皮膚覺得麻,失去觸痛溫壓覺,排泄功能失常等等。也有可能因為影響到自律神經而造成高血壓。
病因:未知。有六成是找不到原因的,其他四成則有許多原因,包括自體免疫,感染,打疫苗後等等。各式各樣的感染都曾報告過和橫斷性脊髓炎有關,包括各式病毒,細菌,甚至寄生蟲。一般認為不是感染本身造成發炎,而是感染引發的抗體反過來造成類似自體免疫疾病攻擊自己的脊髓。
張上淳老師:受試者發生脊髓炎狀況,為了安全起見,暫停臨床試驗的進行,先釐清事件與疫苗接種有無關連,再由專家小組認定可否繼續進行。
臨床試驗進行當中監測有無副作用、不良反應本就是相當重要的部份;類似的模式在國內執行臨床試驗也是一樣,必須密切監測所有近行當中受試者有無出現不良反應,若遭遇問題也必須暫停。
黃立民老師:研發新型疫苗時,如果受試者罹患脊髓炎「這真的很麻煩」,因研究單位通常無法釐清脊髓炎與接種疫苗是否有關,目前也已暫停人體臨床試驗,釐清受試者施打疫苗及脊髓炎發病時間的相關性,但這過程通常很漫長,一旦無法釐清,將使得疫苗要或不要繼續研發陷入兩難。
04b解讀:
1.首先要強調,這是雙盲的臨床試驗,目前應該還沒確認產生脊髓炎這一例到底是實驗組還是對照組。若是對照組,那這個新冠疫苗沒事。但如果真的是新冠疫苗造成,我必須說,這個疫苗研發真的遇上大麻煩了。許多疫苗最怕觀察到的副作用就是產生類似這樣自體免疫攻擊神經系統的稀有疾病,類似的病還有如格林—巴利症候群(Guillain-Barré syndrome),急性瀰漫性腦脊髓炎(Acute disseminated encephalomyelitis,ADEM)等。
2.橫斷性脊髓炎是每百萬人僅有4.6人的稀有疾病,如果你現在收案到幾千幾萬人就產生了一例,在一般的狀況下,這家藥廠也許會考慮放棄這個疫苗,重新研發。但在新冠疫情嚴峻的狀況下,是否值得做下去也許有更複雜的考慮。
3.不過也要釐清一點,橫斷性脊髓炎本身的診斷也複雜,他需要和許多其他的疾病作鑑別診斷。因此可能要完全釐清還需要一些時間。也誠如黃立民老師所說,通常非常難以確定是否真的和疫苗有關或無關。
4.總之,就等後續的詳細報告出來吧。
延伸閱讀:
Wiki百科 Transverse myelitis條目
Idiopathic Transverse Myelitis and Neuromyelitis Optica: Clinical Profiles, Pathophysiology and Therapeutic Choices
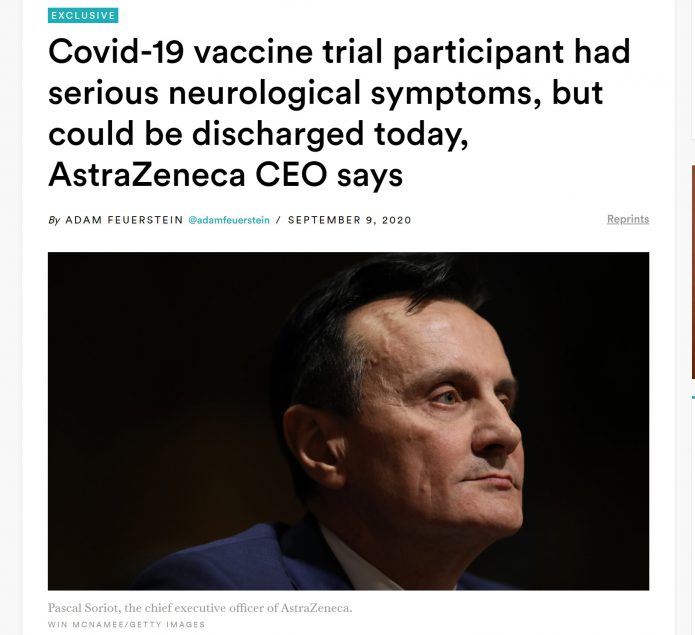
2020.9.10更新:STAT網站又有報導了。
阿斯特捷利康的CEO Pascal Soriot在9月9日星期三早上召開了一個和投資人的私下會議,於會議中有以下資訊。
重點是:
1.這個英國女性產生神經學方面的症狀,症狀和橫斷性脊髓炎吻合,但她的診斷還沒最後確認,還需要做更多檢查。
2.目前此受試者的症狀已改善到可出院。
3.此人應該是在新冠疫苗組,有注射疫苗。
4.七月時也有過一次暫停,那次有一位受試者發生了多發性硬化症(multiple sclerosis),後來判定和新冠疫苗無關。
會議中有三個投資人和STAT網站爆料以上訊息。而網站向阿斯特捷利康的發言人求證,沒有得到回應。
目前為止,阿斯特捷利康官網的聲明中關於此受試者的狀況寫的訊息很少,僅說英國的第三期臨床試驗受試者發生無法解釋的疾病,做為臨床試驗的標準程序,一個獨立的委員會啟動了調查,目前臨床試驗暫停。
再次聲明,這是STAT網站的報導,尚未經過官方證實。橫斷性脊髓炎這個診斷本身,也還沒有經過官方證實。
Statement on AstraZeneca Oxford SARS-CoV-2 vaccine, AZD1222, COVID-19 vaccine trials temporary pause
內容如下:
As part of the ongoing randomised, controlled clinical trials of the AstraZeneca Oxford coronavirus vaccine, AZD1222, a standard review process has been triggered, leading to the voluntary pause of vaccination across all trials to allow an independent committee to review the safety data of a single event of an unexplained illness that occurred in the UK Phase III trial.
This is a routine action which has to happen whenever there is a potentially unexplained illness in one of the trials, while it is investigated, ensuring we maintain the integrity of the trials.
In large clinical trials, illnesses will happen by chance and must be independently reviewed. AstraZeneca is working to expedite the review of the single event to minimise any potential impact on the trial timeline. We are committed to the safety of our participants and the highest standards of conduct in our trials.
Pascal Soriot, Chief Executive Officer, said: “At AstraZeneca we put science, safety and the interests of society at the heart of our work. This temporary pause is living proof that we follow those principles while a single event at one of our trial sites is assessed by a committee of independent experts. We will be guided by this committee as to when the trials could restart, so that we can continue our work at the earliest opportunity to provide this vaccine broadly, equitably and at no profit during this pandemic.”
Covid-19 vaccine trial participant had serious neurological symptoms, but could be discharged today, AstraZeneca CEO says
Statement on AstraZeneca Oxford SARS-CoV-2 vaccine, AZD1222, COVID-19 vaccine trials temporary pause
2020.9.10 歐洲疫苗試驗爆脊椎炎喊卡!黃立民:研發進度陷窘境
關於阿斯特捷利康和牛津大學合作的腺病毒新冠疫苗發生疑似脊髓炎一事,來聽聽黃立民老師的解讀。
1.脊髓炎一般是由免疫攻擊所造成的。在所有的免疫攻擊中攻擊脊髓是很少見的,大部分是攻擊皮膚,肝臟,腎臟等等。
2.不過曾經在其他疫苗報告過,像流感疫苗等等,在極少數的狀況下也曾經造成脊髓炎。這個症狀確實曾經和疫苗的副作用連在一起。
3.因為這是個免疫反應,所以通常你注射後二到六周內出現的機會較高,這時候免疫反應正好上來,時間上可能有相關。要去找有沒有別的原因,比方說別的感染或是藥物會造成脊髓炎。如果都找不到,就很難釐清因果關係。
4.這是否會拖累到疫苗研發的進度?
答:這是個嚴重的副作用,廠商通常會請獨立的安全委員會來做決定。可是這種情況下安全委員會也很難做個100%的確定,他通常會給一個建議說這個疫苗和這個副作用可能相關或是可能不太相關。到最後還是廠商自己要做決定。他可能還要和法規單位討論,他可不可以繼續做下去。
2020.9.10 再來看看李秉穎老師的解讀。
1.牛津疫苗打了有脊髓炎,就一定要喊停嗎?
答:我們不打疫苗人們就常常會生病。這在2019H1N1新型流感疫苗在台灣施打的時候就有很多這樣的事件,有的人中風,有的人心肌梗塞,有的人流產。事後我們去做對照的研究,發現這些打的人發生率沒有比沒打疫苗的人高,就是說他是個偶發的時間上的巧合事件,他跟疫苗沒有直接相關。現在的問題是第三期臨床試驗,他沒有辦法馬上做個對照研究,因為這種脊髓炎是滿少見的,對於安全性的考量,通常對於第三期臨床試驗出現這種嚴重不良反應的時候,他就會暫停來評估說這個有沒有和疫苗高度相關。沒有的話你還是會繼續進行。
2.所謂的嚴重不良反應就是說,會威脅到你的生命,或者會導致後遺症,比方說肢體麻痺的副作用,他就會謹慎去審核來判斷疫苗臨床試驗能不能持續。
3.脊髓炎會有哪些症狀?
答:脊髓就是我們龍骨(脊椎骨)中的神經組織,支配我們四肢和軀幹的感覺和運動神經。比方說小兒麻痺病毒就會侵犯脊髓,他喜歡破壞運動神經,有些人可以恢復,但有些人會終身麻痺。其他病毒也會攻擊脊髓,比方說腸病毒等。另外還有一些是自體免疫。
4.橫斷性的脊髓炎大部分是一種自體免疫的作用,常在某個感染後兩三周才開始有症狀,可能是因為某些病毒他具有和我們脊髓神經組織類似的分子構造,當我們的免疫系統去攻擊這個病毒的時候,他所產生的抗體反應回頭去傷害自己的脊髓神經組織。
5.橫斷性的脊髓炎這個病發生率不高,但他並不是很少見的一個東西。現在這個疫苗在大規模的臨床試驗階段,也許這個受試者他剛好得到某個病毒感染,或是產生了一些自體免疫機轉,他不一定和疫苗有關,牛津疫苗是用動物的腺病毒當載體,載有新冠病毒的S蛋白,動物的腺病毒是減毒的,他一定是無害才會把它做成疫苗。而這個新冠病毒的S蛋白也從沒有人說他會引起自體免疫反應,就是說他的構造並沒有和我們人體組織有類似的構造。這兩個東西理論上都不太會引起自體免疫反應,除非說這個受試者是個有免疫缺陷的人,這是活性疫苗的缺點。你這腺病毒是活的,你如果碰到免疫缺陷的人沒辦法控制這個病毒,讓這病毒全身跑傷害神經,這是一種可能。如果是其他的疫苗,像是RNA疫苗或是台灣的次單位蛋白疫苗,就沒有這個顧慮。
6.如果這個受試者病毒培養出某種腸病毒,那可能就是個時間上的巧合,和疫苗沒關係。否則可能就要專家來審議是否有因果關係,第三期臨床試驗可否繼續。

2020.9.14更新:牛津疫苗臨床試驗在英國重啟
英國牛津大學與阿斯特捷利康合作研發的新冠疫苗因一名英國受試者出現神經學症狀後暫停試驗,9月12日在一個獨立委員會完成對疫苗安全性的調查後,已恢復試驗。
牛津大學的聲明
University of Oxford resumes vaccine trial
牛津大學9月12日發表聲明說,會在英國重啟第三階段人體試驗。
牛津表示,像這種大規模的人體試驗,目前已經收案到一萬八千人左右,有些受試者會出現不適是在預期之中,每個受試者都要經過小心的評估以確定安全性。
9月6日開始啟動了標準程序,暫時中止全世界的收案,讓一個獨立的委員會開始檢視安全性的資料,也讓主管單位檢視。目前獨立的委員會已經達成結論並向英國主管機關藥物及保健產品管理局(MHRA,類似美國的FDA)建議,臨床試驗可恢復進行。
因為受試者資料保密,我們無法公布此受試者得到疾病的資訊。
We cannot disclose medical information about the illness for reasons of participant confidentiality.
我們致力保護受試者的安全,遵從最高的臨床試驗準則。會繼續密切監控疫苗的安全性。
阿斯特捷利康也發了聲明
COVID-19 vaccine AZD1222 clinical trials resumed in the UK
阿斯特捷利康也發了聲明,重點:
1.安全委員會還有國際的主管機關審查了關於安全性的資料。
2.安全委員會做了結論,給英國MHRA(類似美國的FDA)的建議是在英國繼續進行此臨床試驗是安全的。所以英國先重啟了。
3.阿斯特捷利康和牛津大學無法揭露更多醫學上的資訊。所有的臨床試驗參與人員還有受試者將會根據臨床試驗的準則,更新到最新的相關資訊。
4.阿斯特捷利康會繼續和各國的法規單位討論看何時可以重啟臨床試驗。
(牛津疫苗目前正在美國、英國、巴西和南非進行三萬人參加的第三階段人體試驗。)
04b解讀:
我個人對目前的作法很有意見。如果任何消息都沒有露出來,基於受試者資料保密,這樣的做法是合理的。
但現在已經有新聞報導說此人疑似是橫斷性脊髓炎(紐約時報,沒有指出消息來源),STAT網站還直接爆料CEO在和投資人的私下會議上說症狀吻合但還要做更多檢查才能確認,而且此人是在疫苗組。
若以上這些資訊是不確實的,你應該要嚴正駁斥。不然你就該多做說明。
如CEO自己都說連診斷都還不確定,那你怎麼能肯定現在繼續做臨床試驗一定是安全的?用資料保密的理由更是荒謬,這肯定紙包不住火的。因為出現疑似這樣的副作用,如他們第三點所言,你的受試者同意書要在可能的副作用那一個說明中詳細說明此例告訴受試者有這樣的風險,不只未來要收案的,之前已經收案的一萬多人可能也要重新叫回來和他們說明或是重填受試者同意書。這樣的資料,後續肯定會被知道的。
這次的事件真的讓大眾對於這個疫苗的信心有重大打擊。我覺得牛津和阿斯特捷利康處理得非常不好。或是應該說,英國的主管機關很勇敢的開了綠燈,這樣責任其實是在他們身上。
只好繼續看下去了…
牛津大學的聲明
University of Oxford resumes vaccine trial
阿斯特捷利康的聲明
COVID-19 vaccine AZD1222 clinical trials resumed in the UK
延伸閱讀:
紐約時報新冠疫苗整理網頁
WHO會更新全球疫苗進度 2020.9.3
疫苗研發的臨床參考要點
BBC中文網:全球各國新冠疫苗研發進展到了什麼程度 2020.4.20
BBC中文網:新冠病毒疫苗研發賽跑 盤點全球領先衝刺臨牀的六名「選手」 2020.5.5
國產新冠疫苗拚8月人體實驗 明春施打有望 1張圖看懂台灣進度 2020.7.17
疫苗新布局:爭取牛津授權、台廠代工有望,國家隊產能為何恐受影響? 2020.8.10
對這個病有較正確的認知遠比哪裡又多了案例重要!
新冠肺炎疫情下的防疫須知 常見問題解答FAQ
2019新型冠狀病毒懶人包 戴口罩勤洗手
冠狀病毒流感化?武漢肺炎疫情走向預測
新冠感染各國分年齡致死率整理 小於49歲致死率較低 小於19歲較不易染病
英國佛系防疫的豪賭 陳時中:目前台灣沒有到那個情況 國家醫療量能無法承擔才會這樣做
台灣疫情
日本確診一例自台灣返日之新冠病毒無症狀感染者 南部讀書的日籍女學生
比利時工程師是台灣本土感染嗎?
彰化縣萬人血清抗體篩檢懶人包 台大公衛和彰化縣衛生局合作研究
專家意見
黃立民教授 新型冠狀病毒訪問共筆
張上淳教授共筆 中央流行疫情指揮中心記者會
李秉穎老師新冠病毒訪問共筆
西班牙流感 1918年流感大流行 別小看流行性感冒!
武漢肺炎發生率與致死率的國際比較 by 陳建仁副總統
治療經驗
新型冠狀病毒 武漢肺炎 COVID-19 治療經驗分享
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯喹
瑞德西韋 remdesivir 新冠治療臨床試驗懶人包
類固醇可降低新冠重症死亡率
小心沉默的肺炎!日本自衛隊中央病院新冠治療經驗
疫苗進度
新冠疫苗進度 進入第三期臨床試驗的疫苗總整理
新冠疫苗懶人包 臨床試驗 疫苗何時會出來?
新冠疫苗爭奪戰 日本對新冠疫苗的超前佈署 台灣何時會有疫苗?COVAX會分配到什麼疫苗?
橫斷性脊髓炎是什麼?阿斯特捷利康和牛津大學合作的腺病毒新冠疫苗懶人包
莫德納(Moderna)的新冠疫苗:mRNA疫苗懶人包
輝瑞/BioNTech新冠疫苗懶人包:東洋破局 需要冷鍊的mRNA疫苗
世界疫情
美國新冠病毒疫情懶人包
東京有抗體者僅0.1% 大阪0.17%?世界各國新冠抗體陽性率 血清盛行率整理
東京面臨感染爆發重大局面 東京封城?首都封鎖?
東京第二波來了嗎?新冠七指標 東京警報(Tokyo alert)彩虹大橋紅色點燈
東京新冠病毒確診單日破百 小池呼籲避免到夜生活繁華街 東京監測指標修改
東京第二波疫情來襲 小池知事發布感染擴大特別警報
通天閣太陽之塔新冠紅綠燈 大阪府知事吉村洋文推出大阪模式
大阪府知事吉村洋文推薦優碘漱口水控制新冠病毒傳播 相關商品銷售一空
沖繩新冠疫情懶人包 沖繩美軍基地群聚感染
日本武漢肺炎 新冠病毒 COVID-19流行地圖
日本旅遊回來要被隔離14天嗎?可退費嗎?何謂旅遊疫情建議等級 流行地區分級?
台灣日本南韓新冠PCR檢驗量及陽性率比較 大阪 vs 北海道
鑽石公主號郵輪新型冠狀病毒疫情懶人包 由一個香港案例傳染給至少135人的海上悲劇




東京8805間旅館比價 京都7134間旅館比價
日本訂房請參考住宿懶人包,林氏璧推薦的二十四家東京旅館,26家大阪旅館,十三家京都旅館。
訂房網站推薦Relux,e路東瀛,Booking.com,Agoda。也可先用 旅館查價網站來看是否有便宜。訂行程網站推薦KKday,KLOOK客路。
到日本上網分享器和SIM卡的問題請看過這兩篇:2023日本上網卡 SIM卡懶人包,日本行動上網分享器懶人包。
各種毒友優惠及現在的活動請見:全日本篇,東京優惠,關西京阪神優惠,九州優惠,北海道優惠,沖繩優惠。
歡迎加入林氏璧的日本自助旅遊中毒者臉書粉絲專頁,或是小狸的日本購物血拼中毒者臉書粉絲專頁,接收最新日本旅遊訊息。近期有什麼活動會在粉絲專頁置頂,LINE官方帳號:@linshibi 則會直接發送最新的優惠訊息。
RSS訂閱/ 以Email訂閱 本站,東京訊息不漏接。
本站導覽 新手第一次到本站的導覽,比較容易找到資料喔。
重要公告 即日起本部落格(包括臉書頁面/私訊/e-mail)在非公開頁面不回答日本旅遊的常見問題,請各位見諒。請一律在日本自助旅遊中毒者臉書社團中問題讓大家集思廣益。
日本/東京自助旅遊的常見問題FAQ 新手請優先閱讀。



