莫德納(Moderna)的新冠疫苗:mRNA疫苗懶人包



美國生物科技公司莫德納(Moderna)和美國國家衛生研究院(NIH)合作的mRNA疫苗「mRNA-1273」,第一期臨床試驗於2020年3月16日開始收案,距離中國的新冠病毒基因排序公布只有63天。第三期臨床試驗於7月27日開始收案,在美國89家醫院收案三萬人。在11月16日宣布了第三期臨床試驗的初步結果,非常令人鼓舞,疫苗的保護效力(efficacy)高達94.5%。
這是最早進入第一期臨床試驗的新冠疫苗,美國政府對此疫苗投資了10億美金。8月11日,美國政府宣布以15億美金購買一億劑的莫德納疫苗,總計投入了25億美金。這個疫苗的特別之處是它與傳統的疫苗研發路徑不同,不使用新冠病毒本身的某部分來製作疫苗,而是找出病毒表面的棘狀蛋白(spike protein,又稱S蛋白)的核酸序列,由實驗室生成的mRNA(信使核糖核酸)序列注射進人體做為疫苗。動物實驗顯示,注射疫苗的老鼠可以有效防止病毒在肺的增生。
這篇就來整理一下莫德納疫苗的資訊吧。
2020.5.18:莫德納(Moderna)的mRNA疫苗第一期臨床試驗初步結果公布後,股價應聲大漲24%
2020.5.19:波士頓環球報旗下媒體STAT的一篇質疑文章,又讓莫德納股價重挫。
2020.5.22:佛奇(Anthony Fauci)對於莫德納疫苗的第一期臨床試驗初步結果審慎樂觀。
2020.7.16:莫德納(Moderna)的mRNA疫苗第一期臨床試驗結果發表,第二期也完成,準備進入第三期
2020.11.16:莫德納mRNA新冠疫苗保護效力達94.5%!
2020.12.2:莫德納更新報告:94.1%保護力,且可預防重症
2020.12.16 美國FDA公告莫德納疫苗詳細資訊 17日開會審議
2020.12.18:美國FDA獨立顧問小組17日開會,20票對0票,1票棄權,贊成莫德納疫苗的緊急授權使用
比較簡單進入第三期疫苗的表整理在這一篇
新冠疫苗進度 進入第三期臨床試驗的疫苗總整理

東京必備優惠券一整包 關西京阪神必備優惠券一整包
2020.12.18:美國FDA獨立顧問小組17日開會,20票對0票,1票棄權,贊成莫德納疫苗的緊急授權使用
1.美國FDA獨立的顧問小組經過8小時的遠距視訊會議(全程線上直播),以20票贊成0票反對,1票棄權,建議莫德納新冠疫苗可通過緊急授權使用。
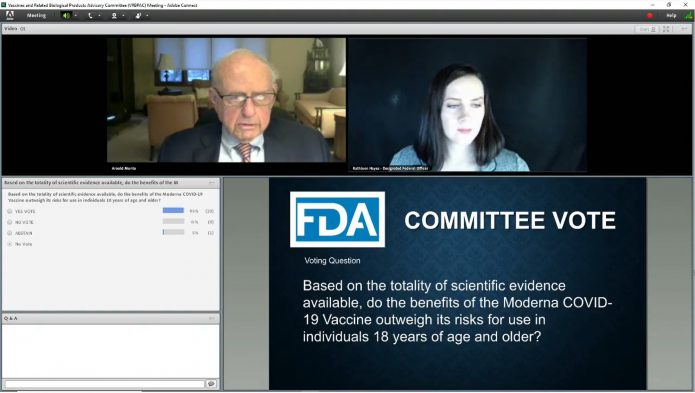
專家們投票表決的問題是:根據目前所有的科學證據,在18歲以上的人們使用莫德納新冠疫苗是否其好處大於風險?
2.長達八小時的會議中提到種種討論,過敏的問題再度被提到。目前為止輝瑞/BNT疫苗至少有3例發生可能致命的過敏性休克(anaphylaxis ),2人在英國,1人在美國阿拉斯加。這3人皆已恢復或是正在恢復中。雖然同為mRNA疫苗,但輝瑞和莫德納疫苗成分還是有所不同的,因此很難說會不會有類似的副作用。
3.輝瑞和莫德納新冠疫苗在大型臨床試驗中都沒有發生嚴重過敏的問題,但當廣泛施打時,較稀有的副作用是有可能發生的。在美國,疫苗相關的過敏性休克很罕見,大約每年每百萬人僅有一例。FDA和CDC會即時關注於過敏反應的安全性追蹤。
4.根據莫德納自己之前已經發展的其他8支mRNA疫苗,目前已經在動物試驗還有1700位受試者的資料,沒有和疫苗相關的過敏性休克報告。僅有一例是在注射疫苗後2個月發生,是一位對豆子過敏的受試者。過敏性休克通常在注射疫苗或藥物後幾秒到幾分鐘內發生,因此不認為和疫苗有相關。
5.莫德納公司的研究者強調mRNA疫苗並不會改變人類的基因或是和人的DNA交互作用(DNA疫苗才較可能有這樣的問題),疫苗進入細胞後會迅速的分解,不會長存在人體內。
6.在輝瑞/BNT疫苗中有4例的四個貝爾氏麻痹症(Bell’s palsy,一種暫時性的面部癱瘓),莫德納疫苗組則有3例,對照組也有1例。此不良反應和疫苗不見得相關,但必須繼續監測。
7.莫德納的30338位受試者皆大於18歲,所以申請在18歲以上的緊急使用。上週輝瑞因為有收少部分的16~17歲受試者,因此申請16歲以上。但部分專家認為在16~17歲年齡的資料還不足夠,可能因此造成了兩次贊成票的差距。
8.FDA接下來預期會在美國時間18日星期五做最後決定,但一般來說應該會照顧問小組的建議通過。美國疫情嚴峻,16日星期三單日死亡3611人再度創下新高。若通過緊急使用,約590萬劑莫德納疫苗會在本周末運送至美國各地。
FDA的開會簡報檔案
紐約時報報導:F.D.A. Panel Endorses Moderna’s Covid-19 Vaccine
2020.12.16 美國FDA公告莫德納疫苗詳細資訊 17日開會審議
莫德納新冠疫苗FDA17日也要開會了,會議資料已公告。
FDA Briefing Document Moderna COVID-19 Vaccine
https://www.fda.gov/media/144434/download
照之前部分媒體的下標法,可能看到這樣的新聞:
接種莫德納疫苗釀13死!
美批准施打前夕莫德納疫苗驚傳臨床試驗13死
所以我先來打個預防針吧….
1.美國FDA在審查莫德納疫苗前把詳細報告放上網,比我們之前看到的新聞稿資訊更多。在安全性的陳述方面如下:全球臨床試驗30338位受試者中,追蹤到12月3日總共發生了13例死亡。6人在疫苗組,7人在安慰組。
2.疫苗組2位死亡是大於75歲且有心臟疾病,一位是於注射第1劑21天後死於心肺停止,另一位是注射第2劑45天後死於心肌梗塞。
3.另外2位是死於家中,死因不確定:1位70歲有心臟疾病,於注射第2劑57天後死亡。1位56歲有高血壓,慢性背痛在吃鴉片類止痛藥,於注射第1劑37天後死亡,正式死因是寫頭部外傷。
4.還有一位72歲有克隆氏症( Crohn’s disease)還有短腸症後群,他在注射第2劑40天後因為血小板低下還有急性腎衰竭住院,之後因多重器官衰竭往生。
5.最後一位是在注射第1劑21天後自殺。
6.對照組中,有3位死於心肌梗塞,1位死於腸穿孔,1位死於癌症引發的發炎反應,1位死於新冠,一位死因不明。
7.以上這些死因,發生的機率和一般人在相應年齡發生相關死亡的機率差不多。判斷不是疫苗造成的。
8.死亡之外的嚴重不良反應 (SAE),發生比例在疫苗組是1.0%,在對照組是1.0%。疫苗組比對照組數字上較多的包括了膽囊炎 (0.02%,3例對0例),心肌梗塞 (0.03%,5例對3例),腎結石(0.02%,3例對0例)。對照組比疫苗組數字上較多的包括了肺炎(0.05%),肺栓塞 (0.03%)。不良反應發生在兩組的機率是差不多的。
9.在輝瑞/BNT疫苗中有4例的四個貝爾氏麻痹症(Bell’s palsy,一種暫時性的面部癱瘓),莫德納疫苗組則有3例,對照組也有1例。
1位是67歲有糖尿病的女性,在注射疫苗後32天發生,因為發生此面部麻痺疑似中風住院,此人症狀已改善。第2位是30歲女性,在注射疫苗後28天發生,不過她有症狀前27天有感冒的症狀,此人症狀也已改善。第3位是72歲女性,在注射疫苗22天發生,此人在追蹤期間症狀尚未改善。
研究者認為和疫苗無相關,但FDA認為無法完全排除其可能性。因此建議必須繼續監測是否後續在廣泛施打後是否繼續有貝爾氏麻痹症的發生。
2020.12.2:莫德納更新報告:94.1%保護力,且可預防重症
1.第三期臨床試驗於7月27日開始收案,在美國89家醫院收案三萬人。莫德納上次在11月16日公布期中分析有新冠確診95例,疫苗保護效力達94.5%。兩週後的11月30日更新報告,目前累積到196例新冠確診例,疫苗保護效力還是在94.1%的高檔。
2.新冠確診中11人是疫苗組,185人是對照組。其中有30人新冠重症,還是全部都發生在對照組。對於預防重症的效果維持在100%。目前僅對照組中有一人死亡。
3.疫苗在不同的年齡,種族和性別看起來都有一致的保護力。
4.確診的196人中,有33人超過65歲,42人是有色人種(29位拉丁裔,6位非裔美人,4位亞裔,3位混血兒)
5.繼續監測不良反應中,目前並沒有看到任何嚴重的安全性顧慮。和上次的觀察一樣,在第二劑之後的不良反應較多。
6.以上資料會正式投稿,也將提交美國,歐盟及世界各國緊急授權申請。美國FDA將在12月17日開會決議是否給予緊急授權使用。
一些其他新冠疫苗相關新聞:
1.英國於12月2日率先批准輝瑞/BNT疫苗緊急授權使用。英國已訂購4000萬劑該疫苗,能供2000萬人接種。大約1000萬劑疫苗應該很快供應,其中第一批80萬劑將在未來幾天內運抵英國。英國衛生大臣馬特·漢考克(Matt Hancock)對BBC說,「我現在有信心,從春天開始,從復活節開始,一切都會好起來。明年夏天每個人都會開始慶祝。」
至於英國為何第一個批准的不是自己的牛津疫苗?目前有什麼爭議?明晚9PM直播講給你聽。
2.美國FDA會分別在12月10日和17日開會審查輝瑞和莫德納的緊急授權。歐盟將在12月29日前決定。
3.日本參議院今日通過改正予防接種法(修正預防接種法),提供國民免費接種,由日本政府負擔全部費用。若疫苗接種導致死亡或引起疾病,日本政府還會承擔私人製藥公司的損害賠償。
法律中定位人民有接種疫苗的「努力義務」。
#努力義務 與 #義務是不同的,違反義務是有罰則的,但違反努力義務的話原則上沒有罰則。
2020.11.16:莫德納mRNA新冠疫苗保護效力達94.5%!
在同是mRNA疫苗的輝瑞/BNT傳出好消息後7天,莫德納也公布了疫苗保護效力達94.5%的好消息!
1.第三期臨床試驗於7月27日開始收案,在美國89家醫院收案三萬人。在11月16日宣布了第三期臨床試驗的初步結果,非常令人鼓舞,保護效力(efficacy)高達94.5%,這遠超過FDA要求的五成。
2.這是第一次期中分析,有95例新冠確診。其中5人是疫苗組,90人是對照組。其中有11人新冠重症,全部都發生在對照組。Moderna的CEO說,我們驗證了這個疫苗可以預防新冠疾病,甚至可能包括預防重症。
3.數據與安全監測委員會(Data and Safety Monitoring Boards; DSMB)同時也看了不良反應,並沒有看到任何嚴重的安全性顧慮。多半不良反應是輕度到中度,第三級較嚴重的反應比例超過2%者:在第一劑之後是注射處會痛 (2.7%),在第二劑之後是疲勞 (9.7%),肌肉痠痛 (8.9%), 關節痛 (5.2%), 頭痛 (4.5%),注射處會痛 (4.1%)注射處發紅 (2.0%). 以上不良反應維持都很短。
4.接下來幾週,會向美國FDA送交緊急授權申請。莫德納預期目前產能是每年5億劑疫苗,期望2021年提升到每年10億劑的規模。目前已下的訂單:歐盟1.6億劑,美國1億劑,加拿大5600萬劑,日本5000萬劑,瑞士450萬劑。
佛奇的解讀:
1.這兩個疫苗初步結果efficacy皆超過九成,這比我預期的好。誠實的說,我沒預期到會這麼好。我想期待超過九成是太多了。(佛奇之前常說預期新冠疫苗若有70~75%保護力他就滿意了。)
2.佛奇也對於重症案例的資訊感到鼓舞。我們的主要療效指標是看有症狀的新冠感染,但疫苗到底可不可以減少重症呢?結果很顯著,對照組有11個新冠重症,打疫苗者完全沒有。(輝瑞/BNT研究中沒有報告有重症)
3.莫德納的受試者包括了年長者(超過65歲者有7000人),小於65歲但有慢性病者(5000人)及有色人種(11000人,佔了37%)。疫苗看來對這些重要族群也有保護力。
04b解讀(可以照抄一週前的XD):
1.這一週內,就有輝瑞,俄羅斯,莫德納的好消息傳出。在人類和新冠病毒對抗的戰役中,終於看到了勝利的曙光,可以讓我們有樂觀的理由。疫苗快來了,但這不代表人們可以放鬆,如佛奇所說,疫苗和公衛措施雙管齊下才能控制疫情。特別是歐美這個冬天疫情已經開始,這個冬天的疫情疫苗是遠水救不了近火的。
2.可能可以預防重症,這點也非常重要。我們每年打的流感疫苗保護力僅有40~60%不等,但他可以有效的預防重症,讓你雖然得病但比較輕微。
3.要提醒這僅是新聞稿,詳細資料還沒正式發表。追蹤時間還不夠長,時間更久也許疫苗組還是可能染病。且還有很多問題待解,到底可以徹底預防感染嗎?在不同族群,特別是年長者保護力如何?保護力可維持多久?但我想初步有這樣的結果是很讓人樂觀的。
4.我不太了解為何這兩支RNA疫苗的保存條件可以差這麼多。莫德納疫苗在攝氏零下20度環境可保存六個月,放在一般冰箱也能保存一個月,更容易配送儲存。但輝瑞/BNT疫苗需要存放在攝氏零下七十度極低溫,放在一般冰箱僅能保存5天。兩者冷鍊需求差異極大。
5.莫德納有在COVAX的第一批九支候選疫苗之中。所以從目前資訊看來,從COVAX買到莫德納的機會,應該比輝瑞/BNT高。但看新聞,祥祥說莫德納新冠疫苗並未在COVAX第一波候選疫苗名單,但有可能在第二波名單中。指揮中心之前曾與莫德納公司有過接觸,最近也會積極洽談,了解該藥廠可能的供貨時程與劑量及冷鏈冷藏議題,將盡力爭取購買疫苗。
6.要注意這些感染應該都是發生在近兩個月。許多人一直擔心病毒突變會不會讓疫苗失去保護力,我們至少可以說,起碼到最近應該還沒有發生。
7.雖可能緊急授權,但離大量施打還要好幾個月,如同佛奇之前的預測,佛奇預估2021年第二季或第三季開始,疫苗產量才能逐漸應付大多數人的需求。如果疫苗的研發順利成功,並且按照計畫執行讓愈來愈多人使用;明年第三季和第四季的時候,我們就有機會回復某種形式的正常生活。
8.而台灣目前獲取疫苗的三個途徑:自己生產,單獨去接洽,還有透過WHO的COVAX機制,都應該會比美國的時間表再慢一些。國內疫苗在明年第二季左右若完成第二期臨床試驗,那時要不要直接以緊急授權的方式讓高風險族群或醫護人員施打,會面臨一個很困難的決定。
9.如果別的疫苗陸續出來,效果也不錯,又沒冷鏈問題,那輝瑞和莫德納也不會有太大優勢。比方說阿斯特捷利康、嬌生、諾瓦瓦克斯第三階段臨床試驗應該也會陸續出爐,全球第二波的流行會加速臨床試驗結果出來的時間(因為新冠流行時受試者也較容易染病)。
Dr. Anthony Fauci: ‘Now We Have 2 Vaccines That Are Quite Effective’
佛奇上NBC的今日美國專訪:
1.有兩個疫苗初步結果efficacy皆超過九成,是朝向控制新冠疫情非常重要的一步。
2.預期FDA應該會很快地通過緊急授權,十二月底預期這兩支疫苗就會開始注射在高風險族群。
3.我們可能會有好幾個有效的疫苗,因為其他疫苗也是針對S蛋白產生抗體。
4.你會擔心川普和拜登政權交接的問題?12月1月可能是疫苗施打的關鍵時間。
會。我經歷過六任總統,我知道政權交接的重要。病毒不會叫暫停,兩邊應該要好好溝通,讓整個過程順暢,不要影響疫苗政策的執行。
5.疫苗走在正確的方向,但疫情走在錯誤的方向。這會是你曾警告過的黑暗的冬天嗎?
我怕是的。人們開始對於防疫疲勞(COVID fatigue),忽視最基本的防疫設施:戴口罩,勤洗手,避免群聚。疫苗快來了,但這不是讓我們放鬆,應該要更加努力執行戴口罩這些安全措施,疫苗和公衛措施雙管齊下才能控制疫情。
STAT網站整理了幾個觀點:
1.這兩個疫苗是一樣有效嗎?
目前說這個還太早,雖然最初期的資料看起來是相近的。這不令人意外,因為輝瑞還有莫德納都是mRNA疫苗平台,非常類似。
莫德納公布了受試者包括了年長者/小於65歲但有慢性病者/有色人種的資訊。預期輝瑞應該也有類似的受試者族群,但目前還沒有公布。
2.疫苗的長期保護力未知。
一般預期新冠疫苗不會長久有效。但目前不知道疫苗建立的免疫力到底可以維持多久。此外,目前看的是有症狀的感染。但有沒有可能會讓注射者變成無症狀或比較輕症,但他還是可以傳染?其傳染力會不會降低?
3.目前為止看到的疫苗安全性是值得鼓舞的。
莫德納公布的副作用,沒有任何一個導致住院,都是很快就會改善的。輝瑞也沒有看到嚴重的安全顧慮。
但疫苗安全性還是要繼續追蹤幾個月甚至幾年下去才能建立。
4.這兩個疫苗成功,對於其他疫苗的意義?
雖然是不同的疫苗平台,但其他疫苗也是針對S蛋白產生抗體。因此也有成功的希望。
5.對於mRNA疫苗平台的意義?
mRNA疫苗科技產生30年,新冠病毒從無到有利用這個平台不到一年做出了疫苗,這表示在其他的應用上也有希望。
Moderna之前對茲卡病毒,巨細胞病毒還有流感疫苗的研究都值得繼續下去,BNT針對癌症,HIV,流感的疫苗也值得期待。
6.這兩家公司到2020年底只能產出7000萬劑疫苗,就是3500萬人份。2021年底前可能可以產生23億劑,但全世界有75億人口,這還不夠。除非有別的疫苗會陸續成功。
7.疫苗有效,但如果人們願意施打才有用。
公衛專家說,即使我們有最好的疫苗,但如果人們不願意施打,那也無用武之地。
在民調中顯示,有滿多美國人對疫苗有疑慮,不管是因為覺得新冠疫苗是急就章做出來的,或是覺得其審查過程有政治化。有色人種中不願意施打的比例更高。
參考資料:
新聞稿:Moderna’s COVID-19 Vaccine Candidate Meets its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study
Moderna’s Covid-19 vaccine is strongly effective, early look at data show
With strong data on two Covid-19 vaccines, we have more answers about the road ahead — and questions too

2020.7.16:莫德納(Moderna)的mRNA疫苗第一期臨床試驗結果發表,第二期也完成,準備進入第三期
莫德納(Moderna)的疫苗發表在「新英格蘭醫學期刊」NEJM:An mRNA Vaccine against SARS-CoV-2 — Preliminary Report,兩個月前新聞稿只公布有八位,現在完整報告出爐,全部受試者45人都有測到中和抗體,將於7月27日展開人數達三萬人的第三期臨床試驗。
第一期臨床試驗於3月16日開始收案,距離中國的新冠病毒基因排序公布只有66天。臨牀試驗有45位18~55歲成人健康受試者參加,4月14日完成最後收案。受試者分為三組(每組15人),注射的疫苗劑量各為25微克、100微克和250微克,注射完第一劑後,相隔28天再注射第二劑。
結果顯示:
1.施打第一劑之後,在第15天全部45名臨床試驗參與者體內都產出新冠病毒結合抗體(binding antibodies)。在第29天三個組別的抗體效價(geometric mean titer,GMT)分別為40,227, 109,209,213,526。較高劑量者產生抗體也較多。
2.施打第二劑之後可以看到抗體再度衝高。在第57天三個組別的抗體效價分別為299,751,782,719,1,192,154,可以達到新冠康復者血清相當甚至更高的抗體量(81,543 到 247,768之間)。
3.使用了兩個方式來測中和抗體(neutralizing antibody ),看是否可以對抗活的新冠病毒。在注射疫苗前全部受試者都沒有中和抗體,在43天的時候中和抗體的量都和新冠康復者血清中和抗體量相當(在抗體數值分布的上半部)。第一劑之後還沒有中和抗體,因此建議須要打兩劑。100微克和250微克以PsVNA測的中和抗體量差不多,因此第三期選擇100微克的劑量。以PRNT的方法測,100微克產生的中和抗體量是康復者血清的4.1倍。
4.新冠康復者的血清是來自38個病人,其中15%臨床上是重症(需要加護病房或插管),22%是中等症。63%是輕症。康復者的血清是用同樣的抗體檢測方式。
5.抗體之外也有測T細胞的免疫反應,目前只有25微克和100微克的資料,都可以測出有CD4輔助T細胞(Th1)的反應,但沒有什麼Th2的反應。
6.副作用方面,沒有發生第四級或是嚴重的副作用(SAE),也沒有發生嚴重到必須停止試驗的副作用。超過半數的受試者出現輕、中度副作用,包括疲勞、發冷、頭痛、肌肉痠痛與注射部位疼痛。全身性副作用在第二劑注射後較常見,特別是高劑量。250微克組在第二劑之後有三人發生了第三級副作用,全部副作用都是暫時性的且自己恢復。
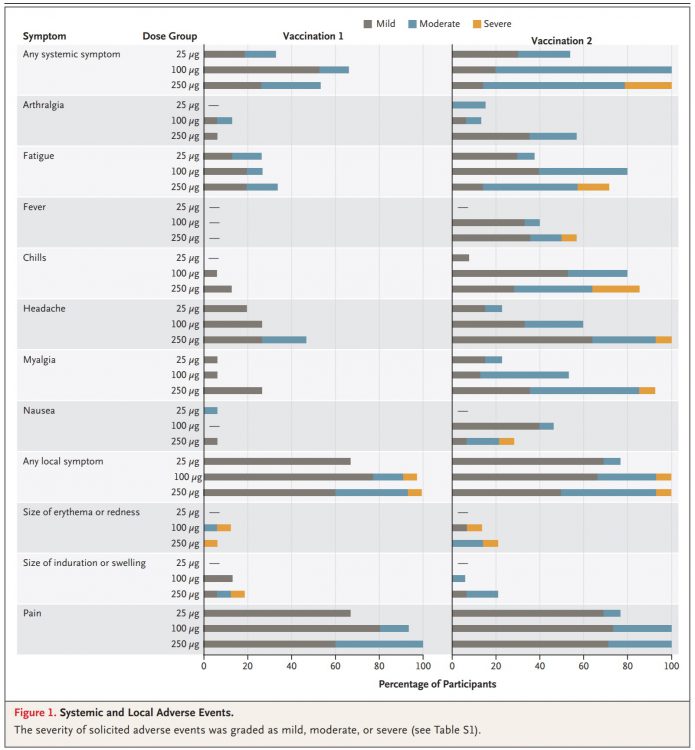
7.全身性副作用:第一劑後全身性副作用在三個組別的比例如下:33%,67%,53%。第二劑後全身性副作用比例如下:54%,100%,100%。值得注意的是,第一劑後沒有人發燒,第二劑後發燒的比例如下:0%,40%,57%。
8.局部副作用:主要是注射部位疼痛,局部紅或是腫的比例都沒有到20%。
9.有3名受試者沒有注射第2劑,其中一人是25微克組,因為雙腿有蕁麻疹;另外兩人分別為25微克組與250微克組,都因被隔離而錯過注射機會,但之後的PCR檢查皆為陰性。
結論:mRNA-1273疫苗可以在所有受試者引發抗體,沒有發生嚴重到必須停止試驗的副作用。這些發現支持這個疫苗的繼續研發。
04b解讀:
1.討論中有提到兩個對此疫苗的重要質疑。免疫力到底可以維持多久?接下來受試者會追蹤一年,看抗體還有T細胞的免疫反應後續會怎麼變化。根據之前SARS和MERS的經驗,特別是輕症患者,抗體可能不會維持很長的時間。因此這樣的追蹤非常重要。
2.第二個重要問題是之前在動物的冠狀病毒疫苗,還有SARS和MERS動物模型中都有看到的疫苗引發的肺病變。這通常和產生效果不佳的中和抗體還有引發Th2的反應有關。mRNA-1273在老鼠的實驗中就可以看到引發很好的中和抗體反應和Th1反應,可以產生CD8 T細胞防止病毒在肺部還有鼻腔增生,而沒有看到免疫傷害。現在在人體試驗看到也有產生很好的中和抗體反應和Th1反應,這個疑慮有比較減輕。
3.佛奇接受訪問時表示,對美國開發疫苗的時間表感到滿意。對疫苗來說,最重要的是他可以模擬自然感染而引發自然感染產生的免疫反應。雖然人數很少,但這就是我們看到的事情。這臨床試驗結果看起來很好,且沒有嚴重的副作用。
“The hallmark of a vaccine is one that can actually mimic natural infection and induce the kind of response that you would get with natural infection. And it looks like, at least in this limited, small number of individuals, that is exactly what’s happening. The data really look quite good, there were no serious adverse events.”
但即使疫苗成功引發免疫反應,佛奇表示,目前仍無法確定這種保護力能維持多久。這是我們目前無法回答的問題,因為疫情爆發至今只有六個月。
4.另外第一期臨床試驗還收了七個組別:50微克在18~55歲(15個受試者),年長者(56~70歲,30個受試者,25,50,100微克),還有老年人(71歲以上,30個受試者,25,50,100微克)。
還有第二期臨床試驗包括18~55歲300人,還有55歲以上300人也已收案完成(50,100微克)。以上這些資料之後也會公開。
5.第三期臨床試驗(COVE study)預計招募3萬名受試者,分為兩組,實驗組是施打100微克的疫苗,對照組則是安慰劑。預計將在7月27日開始收案,收案地點都在美國,來看受試者是否可以真正預防得到新冠感染。研究會持續進行至2022年10月27日,但初步結果應該會提早出爐。在受試者發生53個還有106個新冠感染時都會有內部分析,發生151個感染時應該就可下結論。
6.莫德納聲稱若以100微克的劑量來說,他們每年可以生產五億甚至到十億劑疫苗。
NEJM:An mRNA Vaccine against SARS-CoV-2 — Preliminary Report
STAT: First data for Moderna Covid-19 vaccine show it spurs an immune response
Moderna新聞稿:
2020.7.8 Moderna Completes Enrollment of Phase 2 Study of its mRNA Vaccine Against COVID-19 (mRNA-1273)
2020.7.14 Moderna Announces Publication in The New England Journal of Medicine of Interim Results From Phase 1 Study of Its mRNA Vaccine Against COVID-19 (mRNA-1273)
2020.5.23更新:佛奇對於莫德納疫苗的第一期臨床試驗初步結果審慎樂觀
終於等到了佛奇對於莫德納(Moderna)的mRNA疫苗第一期臨床試驗初步結果的評論。佛奇上了兩個媒體專訪,表達他受到此初步結果的鼓舞,採取審慎樂觀的態度。
Dr. Anthony Fauci says positive early results from the phase 1 study of Moderna’s Covid-19 vaccine are a good sign, “because it reached, and went over, an important hurdle in the development of the vaccine. That’s the reason why, I am cautiously optimistic about it.” #CNNTownHall pic.twitter.com/oqstmfQ6HD
— CNN International (@cnni) May 22, 2020
在星期四晚間CNN的專訪:
1.現在只有八個案例有中和抗體,似乎還是非常早期的結果,為何您會對這個結果感到鼓舞?
佛奇:在疫苗臨床試驗的路途上,有非常多可能的障礙。第一步是第一期臨床試驗,只會有非常少數的受試者,在莫德納(Moderna)的例子是收案45人,三個劑量。第一個問題是,是否安全?很明顯,他很安全。
更重要的是,發現這個疫苗可以產生中和抗體(neutralizing antibodies),而非只是結合但不知有沒有功效的抗體。在第一期臨床試驗來說,這還滿有說服力的。中和抗體是真正可以阻止病毒和人體細胞結合的抗體。 在合理的劑量下可以產生中和抗體,產生的抗體量讓我們相信在更多受試者的時候這個疫苗可以有保護力。雖然人數還不多,但產生中和抗體是非常好的消息,他達到目標且跨越了製造疫苗的一個重要障礙。這是我審慎樂觀看待的理由。
2.您已經在愛滋病病毒的疫苗努力數十年,無法產生中和抗體是否就是愛滋病病毒疫苗無法誕生的原因?
佛奇:你說的完全正確。我和同事已經在愛滋病病毒疫苗領域努力幾十年,我們的身體不會產生對愛滋病毒的中和抗體。但對於新冠病毒,絕大多數的人都是自己康復,可以產生免疫力,產生中和抗體而克服這個感染。而這也是我們在這個第一期臨床試驗觀察到的。我們總是要很小心解讀,但這是一個好消息。
在星期五早上CNBC的專訪則比較長。部分的內容和CNN類似,我就不重覆那部分。
1.在疫苗臨床試驗的路途上,有非常多可能的障礙會延長研發的時間。雖然這是漫長研發過程中的一小步,但在第一期臨床試驗的成功還是很令人鼓舞。七月如果可以順利進入第三期臨床試驗,那是一個很快速的時間。
2.為何只有八人?這些人的年齡為何?
佛奇:這是第一期臨床試驗的限制,開始一定是少人數,且是完全健康的受試者。18~45歲,我不能和你說。只能說就是這個年齡範圍,且是健康的受試者。之後較大型的臨床試驗會在老人,小孩都有受試者。
3.本週也看到中國的康希諾生物股份公司(CanSino Biologics, China)完成了第一期臨床試驗發表在Lancet,還有英國牛津大學新冠候選疫苗在動物試驗結果等等,您對於新冠疫苗會問世的信心有無改變?
佛奇:在疫苗史上,總是有許多失敗,因此我偏向保守看待。但這次世界各國有好幾個候選疫苗一起在走,我看到許多有信譽的疫苗公司,有國家的支持,我認為在我說過的12~18個月之內可以產生安全和有效的疫苗。這是我在一月開始這個疫苗研發時說的,如果我們沒有遇到意外的挫折,我們可能會在2020年12月底就可以有新冠疫苗。當然不能保證一定會有,但我保持審慎樂觀。
4.有可能有不只一個疫苗成功嗎?
佛奇:我很希望如此!你一定會希望很多疫苗能成功,若真的如此,我們會去看疫苗可能也有不同的狀況,比方說有疫苗比較適合年長者注射,有些疫苗比較適合年輕人注射。
5.對於莫德納公司這麼早公布資料方式的看法?
佛奇:莫德納自己看了初步資料,對其很樂觀而公布了。但最後NIAID會投稿在醫學期刊上,讓所有人都能檢視。
影片後面是談到美國的重新開放,瑞德西韋,還有最近佛奇自己的身體狀況。
報導:
Fauci ‘cautiously optimistic’ about Moderna’s experimental coronavirus vaccine
Fauci says it’s still possible that a coronavirus vaccine will be available in the U.S. by December
延伸閱讀:
中國新冠肺炎疫苗人體試驗結果 美專家態度保留

2020.5.21更新:星期一莫德納(Moderna)的第一期臨床試驗初步結果公布後,股價應聲大漲24%。但隨後5月19日因為波士頓環球報旗下媒體STAT的一篇文章,又讓股價重挫,宛如坐雲霄飛車。
這篇文章是由資深感染症記者布蘭威爾(Helen Branswell)採訪一些疫苗專家,指出對於目前的結果應該持保留態度不可盡信。主要有以下五點質疑:
1. 合作官方單位NIAID的沉默
美國國家過敏與傳染病研究院(NIAID)和莫德納合作開發此新冠病毒疫苗,NIAID的科學家選定了此疫苗原型,並執行臨床試驗。本周莫德納公布的初步結果便是出自此第一期的臨床試驗。但一向不低調的NIAID,不但沒有新聞稿,也拒絕對莫德納的聲明做評論。
2.僅有8人有中和抗體?
45名受試者,其中8名受試者有產生中和抗體,剩下37人的實驗結果目前未知。這不代表剩下的人沒有中和抗體,因為測試中和抗體的流程非常耗時且一定要在生物安全等級三的實驗室執行,目前只有8人的結果。目前解讀此結果還是要小心,比方說,受試者年紀分布是18~55歲,莫德納也沒公布這8人的年齡。如果這8人都偏年輕,可能抗體生成的效果會比年長的人好。而這個疫苗較重要的指標應該是要在致死率較高的年長者產生抗體。
3.不知抗體可以存在多久
目前測到的抗體是在受試者接受疫苗兩週後的資料。約翰霍普金斯大學疫苗研究人員杜冰(Anna Durbin)表示,這實在太早了,我們不知道這些抗體會維持多久。
4.抗體比較的標準是感染康復者?
新聞稿中說,疫苗所誘發抗體和新冠感染康復者的血清抗體量大致相同或是明顯超過期數值。耶魯大學的疫苗研究人員羅斯(John “Jack” Rose)表示,康復後的新冠抗體量可以差異懸殊,和疾病嚴重度可能有關。在一個175人的研究中,有10人甚至測不到中和抗體。而光譜另一邊的人則有非常高量的抗體。所以當你說基準是新冠感染康復者時,其實不確定你比較的是什麼。
而當《Stat》向莫德納詢問抗體的比較基準時,莫德納回應:這些資訊會在後續期刊發表中公佈。
5.莫德納公佈實驗結果的方式
莫德納目前為止沒有任何一個疫苗上市,但已經有數個疫苗在其生產線上。可是,莫德納其他疫苗的實驗結果也沒有在科學期刊中刊出,都像這次一樣是在新聞稿中公布。這對於科學界來說是難以信服的。
杜冰說,「他們目前為止沒有發表在新聞稿中公布的任何實驗結果,確實讓人在意。我會抱持樂觀但審慎的態度來看待。我想要看到數據,並且自己對數據進行解讀。但我認為,光是人體對RNA疫苗產生免疫反應,就是令人鼓舞的結果,因為這是針對其他病毒的RNA疫苗所沒有看到過的。這樣的抗體是否足夠,我們現在不知道。」
04b解讀:
1.以新的基因技術想做出有效疫苗是近年的顯學,但如同我上篇和大家提醒的,這家公司很新,mRNA疫苗是個很新的技術,目前為止沒有任何一個疫苗成功上市的。未知的病毒,由未知的新技術來做疫苗,自然會有很多變數。在更大型的臨床試驗中會不會看到不在預期中的副作用,產生的抗體持久與否,是否有長久免疫記憶,是否能夠順利量產,都是要克服的重重關卡。
2.在羥氯奎寧之亂之後(雖然川普說他吃了幾週了XD),我想比較健康的態度應該是審慎樂觀來看待這些新冠的醫療進展消息。我們可以樂觀看待,但要小心求證。
3.非常期待Fauci大師對於此mRNA疫苗的發言。如果大家看到請通知我。
新冠病毒疫苗數據遭質疑:一篇報導,讓莫德納市值蒸發近30億美元
Vaccine experts say Moderna didn’t produce data critical to assessing Covid-19 vaccine

2020.5.19:美國最先進入臨牀試驗的首個候選新冠疫苗:mRNA-1273傳來好消息:第一期的臨床試驗45名受試者在注射候選疫苗後,體內全都產生了新冠病毒抗體,而且沒有明顯副作用。
這是由一家mRNA疫苗及療法開發商Moderna Inc.所研發的疫苗,此計畫得到美國國家過敏與傳染病研究院(NIAID)資助。這個疫苗的特別之處是它與傳統的疫苗研發路徑不同,不使用新冠病毒本身的某部分來製作疫苗,而是找出病毒表面的棘狀蛋白(spike protein,又稱S蛋白)的核酸序列,由實驗室生成的mRNA(信使核糖核酸)序列注射進人體做為疫苗。動物實驗顯示,注射疫苗的老鼠可以有效防止病毒在肺的增生。
第一期臨床試驗於3月16日開始收案,距離中國的新冠病毒基因排序公布只有63天。臨牀試驗有45位18~45歲成人健康受試者參加。受試者分為三組(每組15人),注射的疫苗劑量各為25微克、100微克和250微克,注射完第一劑後,相隔28天再注射第二劑。
初步結果顯示:
1.目前有的抗體資料是,25微克和100微克組的第43天資料,還有250微克組的第29天資料。(因為要看前兩個劑量沒有重大副作用,才可以給更高劑量,所以進行不同步)
2.全部45名臨床試驗參與者在注射疫苗15日時,體內全都產出新冠病毒抗體。劑量越高產生的抗體量越高。
3.在25微克和100微克組,施打第二劑之後可以看到抗體再度衝高。
4.注射第二劑的兩週後(第43天),25微克組(15人)測到的結合抗體(binding antibodies)量和新冠患者復原者的血清抗體量大致相同。
5.注射第二劑的兩週後(第43天),100微克組(10人)測到的結合抗體(binding antibodies)量明顯超過新冠患者復原者的血清抗體量。有5人還沒有資料。
6.目前有用 plaque reduction neutralization (PRNT) assays的方式測了八位受試者的中和抗體(neutralizing antibody ),看是否可以對抗活的新冠病毒。25微克和100微克組各四人。和結合抗體的資料一致,在43天的時候中和抗體的量都和新冠患者復原者的血清中和抗體量相當甚至超過。和動物實驗中產生的中和抗體量也差不多。
7.mRNA-1273看來安全耐受性佳,和同公司之前mRNA的疫苗經驗差不多。25微克和100微克組各1人發生的第三級副作用是注射處紅腫。250微克組在第二劑之後有三人發生了第三級全身性副作用,全部副作用都是暫時性的且自己恢復。沒有發生第四級或是嚴重的副昨用(SAE)。
8.根據以上資料,第二期臨床試驗會修改為50微克和100微克兩組。會根據第二期的結果來決定未來七月大型第三期臨床試驗的劑量,可能是在25微克到100微克之間。
04b解讀(寫這一段,當年做疫苗臨床試驗的甘苦都湧上心頭):
1.疫苗的第一期臨床試驗的觀察重點是安全性及耐受性,因為這是第一次用在人體(first in human),需要非常的小心觀察。因此一定是要收完全健康的自願受試者,劑量從低到高,且有任何令人擔心的副作用,很可能這個臨床試驗就宣告失敗了。
2.這個mRNA疫苗的好處是他不像傳統病毒疫苗都會包含病毒的成分,他只是改mRNA的核酸序列,成分沒有這麼不可預測,因此他的安全性是比較能預期的。也因為不用取得病毒株本身,僅要有核酸序列即可做出疫苗,這種技術才能這麼快做出來。
3.第一期臨床試驗除了安全性外,也可收集初步的抗體生成性(immunogenicity)資料。就如同這個試驗做了三種不同劑量,從而決定第二期臨床試驗應該要給予的劑量。
4.我不是很確定新聞稿中所言結合抗體和中和抗體有什麼區別。中和抗體才是真正可以抑制病毒的抗體,為何不一開始就測中和抗體呢?為何僅有8人資料就公開,怎麼不測完才公開呢?
5.要提醒的是這個結果是Moderna公司的新聞稿,還沒有投稿公布完整詳細資訊。且這家公司很新,mRNA疫苗是個很新的技術,雖然此公司在過去四年總共進行了九個疫苗臨床試驗,但目前為止沒有任何一個疫苗成功上市的。進展到最後面的也只不過是巨細胞病毒(CMV)的第二期臨床試驗。讓我們繼續看下去…..
疫苗飆速!Moderna初階臨床試驗才報喜 立即籌資拚產能
Moderna Announces Positive Interim Phase 1 Data for its mRNA Vaccine (mRNA-1273) Against Novel Coronavirus
Moderna’s Work on a Potential Vaccine Against COVID-19
延伸閱讀:對這個病有較正確的認知遠比哪裡又多了案例重要!
新冠肺炎疫情下的防疫須知 常見問題解答FAQ
2019新型冠狀病毒懶人包 戴口罩勤洗手
冠狀病毒流感化?武漢肺炎疫情走向預測
新冠感染各國分年齡致死率整理 小於49歲致死率較低 小於19歲較不易染病
英國佛系防疫的豪賭 陳時中:目前台灣沒有到那個情況 國家醫療量能無法承擔才會這樣做
台灣疫情
日本確診一例自台灣返日之新冠病毒無症狀感染者 南部讀書的日籍女學生
比利時工程師是台灣本土感染嗎?
彰化縣萬人血清抗體篩檢懶人包 台大公衛和彰化縣衛生局合作研究
專家意見
黃立民教授 新型冠狀病毒訪問共筆
張上淳教授共筆 中央流行疫情指揮中心記者會
李秉穎老師新冠病毒訪問共筆
西班牙流感 1918年流感大流行 別小看流行性感冒!
武漢肺炎發生率與致死率的國際比較 by 陳建仁副總統
治療經驗
新型冠狀病毒 武漢肺炎 COVID-19 治療經驗分享
新型冠狀病毒的抗病毒藥物治療 瑞德西韋 法匹拉韋 硫酸羥氯喹
瑞德西韋 remdesivir 新冠治療臨床試驗懶人包
類固醇可降低新冠重症死亡率
小心沉默的肺炎!日本自衛隊中央病院新冠治療經驗
疫苗進度
新冠疫苗進度 進入第三期臨床試驗的疫苗總整理
新冠疫苗懶人包 臨床試驗 疫苗何時會出來?
新冠疫苗爭奪戰 日本對新冠疫苗的超前佈署 台灣何時會有疫苗?COVAX會分配到什麼疫苗?
橫斷性脊髓炎是什麼?阿斯特捷利康和牛津大學合作的腺病毒新冠疫苗懶人包
莫德納(Moderna)的新冠疫苗:mRNA疫苗懶人包
輝瑞/BioNTech新冠疫苗懶人包:東洋破局 需要冷鍊的mRNA疫苗
世界疫情
美國新冠病毒疫情懶人包
東京有抗體者僅0.1% 大阪0.17%?世界各國新冠抗體陽性率 血清盛行率整理
東京面臨感染爆發重大局面 東京封城?首都封鎖?
東京第二波來了嗎?新冠七指標 東京警報(Tokyo alert)彩虹大橋紅色點燈
東京新冠病毒確診單日破百 小池呼籲避免到夜生活繁華街 東京監測指標修改
東京第二波疫情來襲 小池知事發布感染擴大特別警報
通天閣太陽之塔新冠紅綠燈 大阪府知事吉村洋文推出大阪模式
大阪府知事吉村洋文推薦優碘漱口水控制新冠病毒傳播 相關商品銷售一空
沖繩新冠疫情懶人包 沖繩美軍基地群聚感染
日本武漢肺炎 新冠病毒 COVID-19流行地圖
日本旅遊回來要被隔離14天嗎?可退費嗎?何謂旅遊疫情建議等級 流行地區分級?
台灣日本南韓新冠PCR檢驗量及陽性率比較 大阪 vs 北海道
鑽石公主號郵輪新型冠狀病毒疫情懶人包 由一個香港案例傳染給至少135人的海上悲劇




東京8805間旅館比價 京都7134間旅館比價
日本訂房請參考住宿懶人包,林氏璧推薦的二十四家東京旅館,26家大阪旅館,十三家京都旅館。
訂房網站推薦Relux,e路東瀛,Booking.com,Agoda。也可先用 旅館查價網站來看是否有便宜。訂行程網站推薦KKday,KLOOK客路。
到日本上網分享器和SIM卡的問題請看過這兩篇:2023日本上網卡 SIM卡懶人包,日本行動上網分享器懶人包。
各種毒友優惠及現在的活動請見:全日本篇,東京優惠,關西京阪神優惠,九州優惠,北海道優惠,沖繩優惠。
歡迎加入林氏璧的日本自助旅遊中毒者臉書粉絲專頁,或是小狸的日本購物血拼中毒者臉書粉絲專頁,接收最新日本旅遊訊息。近期有什麼活動會在粉絲專頁置頂,LINE官方帳號:@linshibi 則會直接發送最新的優惠訊息。
RSS訂閱/ 以Email訂閱 本站,東京訊息不漏接。
本站導覽 新手第一次到本站的導覽,比較容易找到資料喔。
重要公告 即日起本部落格(包括臉書頁面/私訊/e-mail)在非公開頁面不回答日本旅遊的常見問題,請各位見諒。請一律在日本自助旅遊中毒者臉書社團中問題讓大家集思廣益。
日本/東京自助旅遊的常見問題FAQ 新手請優先閱讀。




感謝分享這麼充實的資訊,看了林大的文章知識、新聞增加不少 ^^
您好,想請問我現在在一個落後國家,但有機會打莫德納,如果不幸打到『退冰』的,會怎麼樣嗎 (抖)